Крахмал синеет при наличии в растворе
Крахмал с йодом. Реакция невидимости
Описание:
Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба. Крахмал в качестве резервного питания накапливается в клубнях, плодах, семенах растений. Так, в клубнях картофеля содержится до 24 % крахмала, в зёрнах пшеницы — до 64 %, риса — 75 %, кукурузы — 70 %.
С помощью йода можно открыть самые незначительные количества крахмала.
йод + крахмал => соединение темно-синего цвета
I2 + (C6H10O5)n => I2*(C6H10O5)n
(желт.) (прозр.) (синий)
К разбавленному раствору крахмала добавляем немного раствора йода. Появляется синее окрашивание. Нагреваем синий раствор. Окраска постепенно исчезает, так как образующееся соединение неустойчиво. При охлаждении раствора окраска вновь появляется. Данная реакция иллюстрирует обратимость химических процессов и их зависимость от температуры.
Если более подробно, то...
Крахмал представляет собой природный полимер. Причем крахмал не индивидуальное вещество, а смесь двух полимеров состава (С6Н10О5)n –амилозы (10–20 %) и амилопектина (80–90 %), состоящих из остатков a-D-глюкозы.
В целом крахмал – это белое твердое вещество без запаха и вкуса, малорастворимое в холодной воде.
Являясь многоатомным спиртом, крахмал образует простые и сложные эфиры. Характерной качественной реакцией на крахмал является его реакция с йодом.
При взаимодействии йода с крахмалом образуется соединение включения (клатрат). Клатрат – это комплексное соединение, в котором частицы одного вещества («молекулы-гости») внедряются в кристаллическую структуру «молекул-хозяев». В роли «молекул-хозяев» выступают молекулы амилозы, а «гостями» являются молекулы йода. Попадая в спираль, молекулы йода испытывают сильное влияние со стороны своего окружения (ОН-групп), в результате чего увеличивается длина связи до 0,306 нм (в молекуле йода длина связи 0,267 нм). Данный процесс сопровождается изменением бурой окраски йода на сине-фиолетовую (l макс 620–680 нм).
Амилопектин, в отличие от амилозы, дает с йодом красно-фиолетовое окрашивание (lмакс 520–555 нм). Хотя содержание амилопектина в зернах крахмала в несколько раз превышает количество амилозы, тем не менее синее окрашивание, возникающее при действии йода на амилозу, перекрывает красно-фиолетовую окраску амилопектина. Окраска исчезает при нагревании и восстанавливается при охлаждении крахмального клейстера.
Крахмал широко распространен в растениях и является для них резервным источником энергии. В основном он содержится в клубнях, семенах и корнях в виде зерен.
Крахмал используют как пищевой продукт, компонент лекарственных средств и для накрахмаливания белья. Его применяют для получения патоки, глюкозы и этилового спирта, а также в аналитической химии для обнаружения йода.
Эксперимент по химии: Кислотный гидролиз крахмала
<< Видео по органической химии
Кислотный гидролиз крахмала
Описание.
Кислоты гидролизируют крахмал с образованием молекул глюкозы. Кислотный гидролиз крахмала можно наблюдать на примере лабораторного опыта с нагреванием раствора крахмала с серной кислотой.
Для возможности наблюдать этапы гидролиза до окончательного расщепления крахмала до глюкозы, приготавливаются пробирки с сильно разбавленным водным раствором йода. В них будет происходить контрольная качественная реакция на крахмал с йодом. В случае если в испытуемом растворе будет определяться наличие остатков крахмала – пробы покажут это.
Гидролиз крахмала до молекул глюкозы:
(С6Н10O5)n + nН2О (H+) = nС6Н 12О6
Тот факт, что в растворе отсутствует крахмал, качественная реакция с йодом покажет это - гидролиз крахмала считается завершенным в тот момент, когда раствор в пробирках с йодным раствором больше не синеет.
Следующий этап эксперимента – определение наличия глюкозы в растворе, где прошел кислотный гидролиз крахмала. Качественная реакция на глюкозу – реакция на альдегидную группу с раствором щелочи и сульфатом двухвалентной меди. Раствор приобретает яркий голубой оттенок, что свидетельствует о появлении сахарата двухвалентной меди.
Чтобы убедиться в том, что это соединение имеет альдегидную группу, проводим качественную реакцию на альдегиды, подогревая раствор. В случае обнаружения альдегидной группы, раствор приобретает красно-коричневый цвет из-за образовавшегося оксида одновалентной меди.
C6H12O6 + 2Cu(OH)2 = (HO)Ch3-CH(OH)-CH(OH)-CH(OH)-CH(OH)-COOH + Cu2O↓+ 2 H2O
С помощью этого эксперимента удалось наглядно убедиться в том, что кислотный гидролиз крахмала проходит с распадом крахмала на молекулы глюкозы.
Волшебник «синий йод»
Это йодированный крахмал. Его легко приготовить в домашних условиях. Для этого надо в 50 мл теплой воды развести 10 г картофельного крахмала (1 ч. ложка с верхом), размешать, добавить 10 г сахарного песка и 0,4 г лимонной кислоты (несколько кристалликов). Одновременно с этим вскипятить 150 мл воды и в кипяток влить полученный раствор крахмала. Смесь размешать, охладить и добавить 1 ч. ложку 5-процентного спиртового раствора йода, после чего она окрасится в синий цвет. Это и есть тот самый «синий йод».
Присутствующие в препарате сахар и лимонная кислота необходимы для улучшения его вкуса. Кроме того, они препятствуют разложению «синего йода», поэтому он может храниться в закрытом сосуде при комнатной температуре, не теряя своих свойств, в течение многих месяцев.
«Синий йод» открывали несколько раз. Но наиболее полное описание его лечебных свойств дал ученый из Санкт-Петербурга В. Мохнач. Он впервые опробовал этот препарат на себе в годы Великой Отечественной войны, когда заболел тяжелой формой бактериальной дизентерии. А в 50-х годах с его участием в медицинских учреждениях Ленинграда было проверено действие препарата на большой группе больных дизентерией, колитами и энтероколитами, состояние которых оценивалось как тяжелое и средней тяжести. Суточная доза приема препарата для этих больных составляла 500 г. Нередко бывает, что при лечении острых и хронических кишечных инфекций применяются и значительно большие дозы. Достаточно сказать, что сам Мохнач увеличивал дозу приема «синего йода» до 1500–2000 г в сутки.
При язвенных поражениях толстого кишечника «синий йод» вводится в виде клизм по 50 г ежедневно в течение недели.
При конъюнктивите в течение недели в глаза закапывается по 2–3 капли специально приготовленного раствора (1 ч. ложка «синего йода» разводится в 10 ч. ложках теплой дистиллированной воды) утром и вечером.
При стоматите препарат разводят теплой водой и используют этот раствор для полоскания полости рта 2–3 раза в день.
При приступах колита чайными ложками пейте «синий йод». В начале лечения может наблюдаться рвота, не бойтесь этого. Если приступ колита начали лечить вечером, то до утра следует выпить не менее стакана (суточная норма). В дальнейшем лечение можно продолжать, пока болезнь не утихнет совсем.
Расстройства желудка. Известная российская целительница В. Травинка лечит этот недуг комбинацией «синего йода» и голубой целительной глины. Предварительно готовит глиняную воду (1-1,5 столовой ложки глины на стакан воды) и дает выпить этот раствор за час до приема «синего йода». Глина обладает прекрасным свойством вытягивать шлаки и токсины из организма, а йод обеззараживает и нейтрализует организм от вредных микробов.
Ожоги. Налейте «синий йод» в пластиковую бутылку любой емкости с резьбой и через пульверизатор - чтобы щадить рану- распыляйте лекарство по обожженному месту. Можно наложить на обожженное место смоченный в «синем йоде» тройной слой марли. По мере высыхания компресса снова смочите марлю.
С помощью «синего йода» улучшается эластичность кровеносных сосудов, что позволяет рекомендовать его для лечения последствий инсульта. «Синий йод» помогает нормализовать и высокое, и низкое кровяное давление. Кроме того, благодаря седативным свойствам его можно принимать в качестве успокоительного средства.
Соединение йода с крахмалом нейтрализует его токсичные свойства, поэтому «синий йод» не вызывает отравления и может употребляться в значительных дозах. Кроме того, входящий в состав препарата крахмал при приеме внутрь обволакивает язвы и другие пораженные места слизистой желудочно-кишечного тракта, создавая некий защитный слой, способствующий быстрому излечению. Сам же йод стимулирует деятельность поджелудочной железы, являющейся защитницей всего нашего организма.
Щитовидная железа не только защищает наш организм от вирусов и микробов, но и активно участвует в обмене веществ, снимает нервное напряжение, пополняет энергетические ресурсы организма, потраченные нами в течение трудового дня. Нарушение же функций щитовидной железы приводит организм к расстройству, так как щитовидной железе подвластны и центральная нервная система, и процессы кроветворения, и сопротивляемость организма инфекциям и даже раковым клеткам.
А нормально щитовидная железа может функционировать только при достаточном количестве йода в организме. Это примерно 300 мг в сутки. Поэтому наряду с лечением тех или иных болезней «синий йод» рекомендуется принимать и для профилактики йодной недостаточности. Продолжительность профилактического курса составляет не более месяца. В этот период «синий йод» следует принимать 2 раза в неделю по 1 ч. ложке. Для тех, у кого вес превышает 65 кг, дозу приема можно увеличить до 2 ч. ложек.
Есть еще аптечный препарат «йодинол», приготовленный на основе поливинилового спирта. «Йодинол» — это тоже «синий йод». Он является прекрасным антисептиком, нетоксичный, недорогой и очень устойчивый препарат, который может долго храниться.
Необходимую организму дозу йода можно ввести также с помощью раствора Люголя. Доза приема — всего одна капля. Ее рекомендуется принимать каждую неделю по вторникам и пятницам до еды. Для этого в стакан с подкисленной яблочным уксусом теплой кипяченой водой надо добавить одну каплю раствора Люголя, тщательно перемешать и выпить весь стакан этой смеси небольшими глотками, запивая чаем или кофе. В условиях повышенной нагрузки на организм эту процедуру надо выполнять ежедневно до тех пор, пока нагрузки на организм не уменьшатся.
Первым признаком йодной недостаточности в организме является сильная усталость, быстрая утомляемость, повышенная раздражительность, чувство разбитости по утрам. При появлении этих тревожных сигналов вспомните о «синем йоде». С его помощью вам удастся укрепить здоровье и сохранить хорошее настроение. Он даст вашему организму такой заряд бодрости, что вы без труда сможете отказаться от кофе и крепкого чая.
«Синий йод» сохраняет свои лечебные свойства до тех пор, пока сохраняется его темный цвет. Единственное ограничение – его не следует принимать людям, страдающим тромбофлебитом.
Татьяна ПЕТРОВА.
Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)
Не передать, насколько мне приятно это писать. Данная статья
полностью профинансирована подписчиками каналаLAB66. Ни один производитель описанных в тексте средств - своего участия не проявил, так что никакой скрытой рекламы, чиcтый альтруизм и потребительский интерес :)
Сегодня читаем о самом простом, самом доступном и самом действенном антисептике — про гипохлорит натрия (он же «Белизна»). Совместимость с различными материалами, техника безопасности, свойства и эффективность не только против коронавируса, но и против страшной плесени и ее микотоксинов. В качестве «вишенки» — контрольная закупка магазинных отбеливателей и оценка их состава. Чтобы узнать как в эпоху пандемии нас дурят производители бытовой химии и прочий «менеджерский брат» — идем под кат. И обязательно закидываем в закладки. Эта информация пригодится еще не раз ;)
Важно
! Информацию, предложенную в данной статье, вы не найдете больше ни на одном русскоязычном ресурсе. Поэтому публикую на хабре, на портале высшего пользовательского доверия. Просьба ко всем ресурсам сомнительного качества — давайте ссылку на первоисточник. Не переписывайте без понимания — не плодите бесполезный информационный шум, от которого в последнее время уже и так некуда деться. Разномастному «ученому люду» тоже рекомендую не стесняться писать в своих «методических указаниях» ссылку на Хабр. Я то вижу откуда вы все копируете, книгами 50-60 годов вечно прикрываться не получится ;) Так что настоятельно рекомендую меня уведомлять об использовании материалов, а в свой список литературы писать можно что-то вроде:
Бесараб, С.В. Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)[Электронный ресурс] – Режим доступа: — habr.com/ru/post/494512/- Дата доступа: 04.04.2020.
Предисловие от автора
. Смотрю колонку «сейчас читают» на хабре и с сожалением вижу, что принцип «пока гром не грянет — мужик не перекрестится» работает даже здесь. Один сплошной коронавирус. И вспоминается сразу мне моя статья, опубликованная в конце января (
Коронавирус 2019-nCoV. FAQ по защите органов дыхания и дезинфекции) у которой 30% минусов были с пометкой «не соответствует тематике Хабра». Соответствовать, видимо, начинает лишь тогда, когда указание сверху поступит…
Ладно, чего о грустном говорить. Если пару тысяч читателей еще тогда, в январе, без паники и спешки, смогли купить себе СИЗ и нужные антисептики — можно считать, что цель моя достигнута. А сейчас просто вольюсь в тренд и расскажу об самом простом, доступном и очень эффективном антисептике. Не думаю, что он когда-то сможет исчезнуть так же, как исчез этанол. Сырья хватает, гипохлорит натрия можно производить до тех пор, пока существует электричество…
Есть такая интересная (интересная не только для химика, но и для других специалистов, владеющих английским языком) книга — 100 самых важных химических соединений: Cправочное руководство (The 100 Most Important Chemical Compounds: A Reference Guide). В этом руководстве в разделе солей натрия находятся рядом пищевая сода, карбонат натрия, поваренная соль, гидроксид натрия (средство «Крот») и гипохлорит натрия. В принципе, понятно чем многие из этих солей заслужили такое право. А вот на гипохлорите натрия я остановлюсь сегодня подробнее. Первым делом, конечно же определение:
Гипохлорит натрия представляет собой химическое соединение с формулой NaOCl или NaClO, включающее катион натрия (Na+) и гипохлоритный анион (OCl- или ClO-). Это соединение можно рассматривать как соль неустойчивой хлорноватистой кислоты. Гипохлорит натрия чаще всего встречается в виде бледно-зеленовато-желтого разбавленного раствора, который с 18-го века используется в качестве отбеливающего, а позднее и дезинфицирующего средства. Стоит отметить, что гипохлорит натрия можно считать в некотором роде эндогенным для человека веществом, так как клетки-нейтрофилы иммунной системы человека производят небольшое количество этого вещества внутри фагосом, которые «переваривают» бактерии и вирусы.
С момента своего открытия в 1787 году химиком
Клодом Луи Бертолле(тем самым, которому мы должны быть благодарны за хлопушки, спичечные головки, салюты и проч. изобретения, где используется т.н.
бертолетова соль) гипохлорит натрия достаточно долго выступал сугубо как отбеливающий агент и только примерно с середины 19 века началось его шествие как дезинфектанта. Поэтому пройдусь немного по химическим свойствам, сохраняя «историческую хронологию».
Хлорочка как отбеливатель
Отбеливающий эффект гипохлорита — это целиком и полностью заслуга неустойчивой хлорноватистой кислоты. Ибо эта HClO является очень сильным окислителем (даже сильнее, чем газообразный Cl
2) и может реагировать и разрушать многие типы молекул, включая красители. В водной среде гипохлорит натрия NaOCl обратимо гидролизуется с образованием хлорноватистой кислоты и щелочи:
NaOCl + H2O → HOCl + NaOH
В свою очередь хлорноватистая кислота HOCl распадается на атомарный кислород (O*) и соляную кислоту:
HOCl → HCl + O*
Ну а атомарный кислород — очень ядреная штука, один из мощнейших окислителей на нашей планете. Кстати, именно благодаря атомарному кислороду озон проявляет свои бактерицидные свойства. Так что, в некотором роде, озон и гипохлорит натрия — «кислородные братья» :)
Отбеливающая способность гипохлорита натрия (и подобных ему химикатов) обусловлена их способностью разрушать светопоглощающие структуры (т.н. хромофоры) в органических молекулах. Притом это могут быть не только хромофоры на тканях. Гипохлорит неплохо отбеливает пятна плесени на плитке, зубные пятна, вызванные флюорозом и удаляет пятна от танинов чая на кружках (т.н. «чайный камень»).
если в школе химию знал на тройку - спойлер можешь даже не открыватьХромофоры часто связаны с сопряженными системами, которые представляют собой структуры с чередующимися одинарными и двойными связями. Электроны в сопряженных системах делокализованы и способны существовать на разных молекулярных орбиталях. Электрон в определенном орбитальном состоянии может поглощать энергию и подниматься до более высокого энергетического состояния. Электронные переходы, возникающие в результате поглощения определенных длин волн, создают цвет, который является визуальным дополнением к длине волны поглощенного света. Атомарный кислород гипохлорита натрия либо разрушает сам хромофор, либо разрушает двойные связи в нем и изменяет краситель так, что он больше не может поглощать видимый свет «окрашивающей» длины волны.
Справедливости ради, стоит отметить, что хлорноватистая кислота образует соли не только с натрием, но и, например, с кальцием. Примером может служить та самая хлорная известь, широко используемая из-за своей дешевизны для дезинфекции складских помещений, животноводческих ферм, туалетов и т.д и т.п. На долю гипохлорита натрия приходится около 83% мирового потребления (в роли отбеливателя/дезинфектанта), на хлорную известь — остается 17%. В 2005 году в мире было использовано около 1 миллиона тонн гипохлорита натрия, причем около 53% этого количества использовалось в домашних хозяйствах для дезинфекции и отбеливания белья (+ мытья, т.к. щелочная среда раствора гипохлорита неплохо омыляет жиры и делает их водорастворимыми). Оставшиеся 47% приходились на очистку сточных вод и подготовку питьевой воды (а также очистку бассейнов и градирен ГЭС от биообрастания/водорослей/моллюсков, отбеливание целлюлозы/бумаги/тканей, и использование в роли реактива для химических синтезов). Водоочистной эффект, кстати, это не только дезинфекция. Это и удаление запахов (NaOCl нейтрализует сероводород и аммиак) и даже обезвреживание цианидов в сточных водах (например, после золотодобычи или гальванических ванн).
Хлорочка, как дезинфектант
Любое несчастье как индикатор проявляет самые лучшие и самые худшие черты человека. Так и с пандемией коронавируса. Для меня удивительно, что многие трезвомыслящие, прекрасные специалисты, поддавшись панике начали терять голову и выдавать что-то вроде «гипохлорит не убьет коронавирус» (или еще лучше «коронавирус — это ГМО бактерия»). Меня мало волнует мнение многочисленных youtube-блогеров и диванных аналитиков и т.п. с их дилетантскими «рассуждениями о рыбалке» (в канале
LAB-66уже приходится у особо рьяных кликуш и «одержимых мировым заговором» даже требовать диплом о наличии профильного образования). А вот к информации от WHO, CDC, EPA я стараюсь четко прислушиваться. Ожидаемо, что в мартовском бюллетене выпущенном одной из упомянутых организаций (
EPA’s Registered Antimicrobial Products for Use Against Novel Coronavirus SARS-CoV-2, the Cause of COVID-19) в списке эффективных «коронавирусных» дезсредств оказалось достаточно много гипохлорита. Удивляться здесь нечему, ведь NaOCl — это одно из оптимальнейших дезсредств (из-за комбинации широкого спектра активности, доступности и отсуствия долгосрочного вреда для окружающей среды). По поводу дезинфицирующего эффекта смотрим картинку (кликабельна):

На всякий случай напоминаю, COVID-19 — это болезнь, вызванная оболочечным вирусом SARS-CoV-2, который содержит внутри своего «конвертика» одноцепочную РНК.
В принципе, любые дезинфицирующие средства на основе хлора, так или иначе действуют через образование HOCl (та самая хлорноватистая кислота). Но сильный бактерицидный эффект гипохлорита связан не только со способностью продуцировать атомарный кислород, но и с действием гидроксильных ионов. Щелочная среда нарушает целостность цитоплазматической мембраны и приводит к необратимому ферментативному ингибированию, изменению клеточного метаболизма и деградации фосфолипидов (как при гипероксидировании липидов). Гипохлорит натрия воздействует на ферментативный аппарат бактерий, способствуя необратимой инактивации, вызванной щелочной средой и хлораминированию вызванному хлором. Т.е. можно сказать, что при обработке гипохлоритом зараженного объекта одновременно происходят реакции омыления липидов, нейтрализации аминокислот и хлораминирования. Таким образом не только дезактивируются многие микроорганизмы, но и происходит деградация липидов и жирных кислот, с образованием ПАВ (=мыла) и глицерина, т.е. уже упомянутая реакция омыления. Гипохлорит не только дезинфицирует, но еще и моет :) Логично, что при таком действии выработать резистентность (как к антибиотикам) практически не реально.
При обработке живых тканей важна еще и такая вещь, как биосовместимость. Это способность химического реагента вообще не реагировать с биологическими тканями на протяжении какого-то периода времени (и иметь умеренную реакционную способность в течение недели, постепенно снижающуюся к 0). Высокие концентрации гипохлорита достаточно агрессивны (см. раздел про технику безопасности), но вот в концентрациях 0,5-1% это очень даже биосовместимый препарат. Поэтому гипохлорит натрия высоких концентраций используется для хлорирования воды на некоторых (!) станциях водоподготовки — 12% раствор — некоторых, потому что чаще всего используют хлор в баллонах. 15% раствор используют для обеззараживания сточных вод на очистных сооружениях. Растворы с концентрацией не менее 10% используются для очистки воды в бассейнах и удаления биопленок. Кстати, именно гипохлорит натрия может быть прекрасным средством для уничтожения возбудителей легионеллёза. Эти микроорганизмы, кстати, очень часто в тех самых биопленках и обитают.
Ну а в дезинфицирующих спреях и салфетках, используемых на твердых поверхностях, чаще всего используются концентрации до 1,5%. Кстати, про то, как сделать самодельные салфетки с гипохлоритом я достаточно давно писал на Patreon в своей статье "Реверс-инжиниринг влажной салфетки или Гипохлорита вам в ленту". Кстати, пользуясь случаем выражаю благодарность всем моим «патронам». Вас мало, но вы поддерживаете серьезно!

Традиционно считается, что для обработки больниц и помещений, загрязненных жидкостями организма (кровью и т.п.) необходимо использовать 0,5% раствор. Такой концентрации достаточно, чтобы дезактивировать клостридиум диффициле в фекалиях или уничтожить какие-нибудь папилломавирусы человека. Для обработки/мытья рук чаще всего используется 0,05% раствор гипохлорита, который готовят из гранул (на картинке — выдержка из инструкции по обеззараживанию в условиях эпидемии лихорадки Эбола):

На Западе также активно используется т.н. "
раствор Дакина" (
) он же раствор Карреля-Дакина, он же жидкость Карреля-Дакина. Раствор этот представляет собой разбавленный раствор гипохлорита натрия (от 0,4% до 0,5%) с добавкой стабилизирующих ингредиентов (борная кислота или пищевая сода), и активно используется в качестве антисептика для очистки ран/обработки ожогов и т.п (
метода приготовлениядля интересующихся). Такой раствор
показываетэффективность дезинфицирования для некоторых микроорганизмов даже с концентрацией 0,025%.
Замечание 1. о других «хлорных дезинфектантах»
Помимо упомянутых уже мной гипохлорита натрия и гипохлорита кальция, существуют и другие вещества, способные активно продуцировать хлор (ну а хлор с водой = «малостабильная хлорноватистая кислота HOCl» и далее опять см. п. «Хлорочка, как дезинфектант»). Притом там могут быть и вещества органической природы. На просторах интернета я нашел информацию (скорее всего выдранную из какой-то советской книги по гражданского обороне — потому что многие наименования, да и сами препараты давно перестали существовать). Эта таблица дает примерное представление о спектре препаратов и их сравнительной «дезмощности по хлору». Почистил авторски и предлагаю на ваш суд. Можно, по крайней мере, примерно прикинуть/сравнить активность разных дезсредств (если захочется что-то отличное от старого доброго NaOCl):

Возможно, читателю может встретится такой дезинфектант, как хлорцин (это НЕ украинская мазь с одноименным названием). Это Na-ДХЦК (натриевая соль дихлоризоциануровой кислоты — хлорцин Н) — 30,0% (или К-ДХЦК — 20,0% — хлорцин К), триполифосфат натрия — 6%, ПАВ (сульфонол) -3%, сульфат натрия — до 100%. Хлорцин содержит 11 — 15% активного хлора. Может встречатся и т.н. препарат ДП-2. Зашифрованного названия не стоит пугаться, по сути — обычная трихлороизоциануровая кислота с добавками ПАВ.
Сюда ж внесу и замечание от eteh: "… электролизный ГПХН возможен и 5-7%. При получении, соответственно, не проточным электролизом, а мембранным — из соли и воды без добавления дополнительных реагентов. Ну а выше, да, там только отдельно готовить концентрированный щелочной раствор для насыщения хлором".
Замечание 2. «хлорка которая лечит»
Все яд и все лекарство. Не стали исключением и гипохлорит, который может не только уничтожать все живое, но и лечить, например, поражения кожи. Сразу хочется вспомнить ванны с разбавленным гипохлоритом, которые на Западе (
) десятилетиями использовались для лечения умеренной и тяжелой экземы (
ссылка). Притом механизм действия достаточно долго оставался неясен. Но в 2013 году в Стэнфорде появилась интересная информация (
пруф) о том, что очень разбавленный (0,005%) гипохлорит натрия успешно лечит воспалительные повреждения кожи у лабораторных мышей, вызванные лучевой терапией, переизбытком солнца или старением (
). Мыши с радиационным дерматитом, купавшиеся каждый день по 30 минут в гипохлорите (=«купавшиеся в отечественных бассейнах») имели лучшую динамику заживления кожи и отрастания волос, чем мыши купавшиеся в обычной воде. У старых мышей кожа после купаний вообще становилась моложе, утолщалась, увеличивалась
пролиферация(размножение делением) клеток. Казалось бы вот она, панацея для престарелых правителей, но нет. Эффект исчезал после того, как купания прекращались…
В «медразделе» не грешно упомянуть и про применение гипохлорита натрия в стоматологии (ибо именно стоматологи у меня чаще всего интересовались вопросами концентрации, разведения в и т.п.). Гипохлорит натрия является препаратом выбора в эндодонтии и очистке корневых каналов. Чаще всего стоматологами используются концентрации от 0,5% до 5,25% (стандартный — 2%).
Здесь работает правило — низкие концентрации гипохлорита удаляют преимущественно некротические ткани и некоторые виды бактерий, высокие концентрации — повреждают живые ткани, но наиболее полно уничтожают микробы. Кстати, вместо повышения концентрации можно подогреть раствор (50-60 °C), что даст сравнимую с более концентрированным раствором эффективность в удалении мягких тканей и дезинфицировании корневого канала.
Замечание 3. Об очистке воды в полевых условиях
Тема очистки воды достаточно обширна и вполне достойна отдельной статьи. Я же кратко упомяну об очистке воды в полевых условиях. Ведь бывают ситуации, когда ни то что озонатор или уф-лампу использовать, а даже и закипятить воду тяжело. Поэтому у химических обеззараживателей,
на мой взгляд, пока особой альтернативы не видно. Хлорное обеззараживание может считаться старейшим вариантом полевой дезинфекции воды. Американские военные еще во время Второй мировой войны в составе сухпайка имели таблетки «Halazone», с натриевой солью 4-[(дихлорамино)сульфонил]бензойной кислоты.

Потом постепенно это вещество вытеснил дихлоризоцианурат натрия (тот самых ДХЦК), именно он был в составе широко известных в узких кругах таблеток «Пантоцид». Американский вариант — это ДХЦК спрессованый с адипиновой кислотой и содой, быстрорастворимые таблетки. Стоит отметить, что для полевой дезинфекции могут использоваться и таблетки для обеззараживания бассейнов (двухкомпонентные, содержащие смесь хлорит+хлорат+карбонат натрия и гидросульфат натрия), продуцирующие диоксид хлора. В целом, такой вариант подходит и для обеззараживания питьевой воды. Причем этот вариант, например, эффективен против
лямблийбольше чем обычный хлор. Все описанные варианты — удобны in situ (туристы, военные, МЧС и т.п.). Для вариантов вроде стихийного бедствия или какой-нибудь техногенной катастрофы таблетки могут быть недоступны, а то и слишком дороги. Для этой цели вполне можно использовать и Белизну (желательно без всяких ПАВ-ов и отдушек). Необходимо всего пару капель 5% гипохлорита натрия на литр воды с выдержкой в емкости с закрытой крышкой в течение 30-60 минут. Перед непосредственным употреблением желательно крышку открыть и «дать проветриться». Не стоит сразу лить в себя, как бы там ни хотелось пить.
CDC в рамках своей стратегии «Безопасная система водоснабжения» (SWS) для развивающихся стран рекомендует для обеззараживания воды использовать 0,5–1,5% раствор гипохлорита натрия (две-три капли на литр и экспозиция 30 минут). EPA, кстати, советует использовать 8,25% раствор гипохлорита натрия (две капли на литр и экспозиция 30 минут), важное замечание "удвойте количество отбеливателя, если вода мутная, окрашенная или очень холодная. после обработки вода должна иметь слабый запах хлора. Если нет, повторите дозировку и дайте постоять еще 15 минут перед использованием". Стоит отметить, что на крайний случай, для дезинфекции воды можно использовать и гипохлорит кальция («хлорную известь»).
Замечание 4. «Хлорка» vs плесень, грибки и микотоксины
А затем они повредили его нервную систему русским боевым микотоксином…
Уильям Гибсон «Нейромант»
Существует в немногочисленном мире «химиков, которые в теме» такой «Грааль» как микотоксины.
Обыватель чаще всего ничего про это не слышал, или слышал краем уха (типа «Джонни Мнемоника отравили таким веществом...»). По сути ж, это тема отдельной и очень интересной статьи. Пока же просто скажу, что микотоксины в простейшем применении = плесень, плесневые грибы различных разновидностей, которые могут встречаться на овощах, фруктах, крупах и т.д. и т.п. Микотоксины — невозможно смыть водой или мылом, невозможно удалить срезав подгнившую кожицу. Микотоксины — могут равномерно распределятся по всему объему картошки/яблока и т.д. и т.п. И, к сожалению, многие микотоксины в человеческом организме вызывают множественные симптомы поражения органов (при попадании на кожу, в лёгкие или в желудок). Из-за того, что концентрации их достаточно малы (сомневаюсь, что кто-то постоянно ест гнилые фрукты или плесневелые орехи) — воздействие это растянуто по времени и кажется чем-то привычным (= «заболел от генетической предрасположенности/пьянства/плохого воздуха», а не потому что отравлен микотоксинами из некачественных круп). Про это можно говорить долго, но герой моей статьи гипохлорит, а значит надо бы свести тему к нему.
А сводится все к тому, что гипохлорит натрия в определенных концентрациях может использоваться не только для уничтожения микробов и плесневых грибов (см. таблицу в начале раздела "Хлорочка, как дезинфектант"), но и для дезактивации того, что после них осталось, в т.ч. плесневых, растительных токсинов и токсинов животного происхождения.. Более подробно — смотрите таблицу (30-минутная экспозиция). Плюсик — токсин дезактивируется, минус — нет.

Так что, глянув на таблицу, можно увидеть, что гипохлорит натрия способен дезактивировать Т-2 микотоксин, который выделяется плесневыми грибами рода
Fusarium.
T-2 токсин — трихотеценовый микотоксин, чрезвычайно токсичен для эукариотических организмов. Вследствие употребления заплесневевшего зерна или муки возникают отравления человека или сельскохозяйственных животных. Острые токсические симптомы включают рвоту, диарею, раздражение кожи, зуд, сыпь, волдыри, кровотечение и одышку. Если человек подвергается воздействию Т-2 в течение более длительного периода, наблюдается постепенная дегенерация костного мозга и развивается пищевая токсическая алейкия (АТА).
И уже привычно не отмахнешся, не успокоишь себя фразой «да где тот микотоксин и Fusarium, а где я» и водочкой, привычно, не полечишь… Потому что они — много где. На клубнике например:

Или даже на тыквах...

Так что, вполне себе вариант снижения количества микотоксинов в подозрительных фруктах и овощах — это купание их в щелочном гипохлорите натрия с последующим обычным мытьем. При таком варианте обработки убиваются практически все возможные «поверхностные зайцы».
Стабильность и сроки хранения (=есть ли смысл закупать впрок?)
Если химия и медицина для рядового технаря не особо интересны (достаточно знать работает или нет), то вопросы стабильности при хранении — наоборот, первостепенны. Ведь гипохлорит натрия — вещество малостабильное. При комнатной температуре распадается примерно 0,75 г активного хлора в сутки, т.е. раствор с содержанием 250 г/л гипохлорита натрия теряет примерно половину активного хлора за 5 мес, с содержанием 100 г/л - за 7 мес, 50 г/л - за 2 года, а 25 г/л - за 5–6 лет.
Его устойчивость зависит от ряда факторов:
- Концентрация гипохлорита
- Температура
- Щелочность и значение pH
- Концентрация примесей, которые катализируют разложение и/или образование хлоратов
- Воздействие света
В большинстве случаев распад протекает по таким вот основным механизмам:
2NaOCl → 2NaCl + O2 (A)
3NaOCl → 2NaCl + NaClO3 (B)
Пройдусь по каждому пункту отдельно:
Концентрация: чем более концентрированный раствор, тем быстрее он разлагается, соответственно самые слабые растворы — самые стабильные. Литературные данные указывают на то, что при снижении концентрации гипохлорита натрия в два раза, скорость разложения уменьшается в 5 раз. Это связано с уменьшением общей концентрации ионов и со снижением ионной силы раствора. Разбавление снижает как концентрацию NaOCl, так и концентрацию других ионов (равновесных хлоридов, хлоратов, гидроксидов и т.д. — см. картинку «равновесия рН» ниже).
Температура: распад гипохлорита с повышением температуры в 90% случаев проходит по уравнению (B). Можно держать в уме следующее правило — скорость разложения возрастает в 3–4 раза, для каждых 10 °C для растворов с концентрациями гипохлорита натрия от 5 до 16%. А если напрячься и снизить температуру хранения хлорки до 5 °C (при условии полного отсутствия примесей металлов и других факторов ускоряющих разложение), то хранить в темной бутылке можно будет практически вечно.
Щелочность и рН раствора: для стабильного хранения раствор гипохлорита должен иметь pH от 11,5 до 12,5. В случае разбавленных растворов NaOCl при pH ниже 10,8 скорость разложения начинает значительно увеличиваться, достигая максимального значения в диапазоне 5-9. Но здесь есть нюанс. Когда рН раствора уменьшается, содержание HOCl увеличивается и растет окислительно-восстановительный потенциал (см. картинку с изменением форм активного хлора в растворе гипохлорита натрия в зависимости от рН раствора, Сl2 — молекулярный хлор, ClO–-гипохлорит-ион, HClO-хлорноватистая кислота).

Т.е. для хранения оптимальнее высокощелочные растворы, а для экстренной дезинфекции — растворы с низким рН. Хотя, говоря начистоту, повышать рН тоже необходимо до разумного предела. Если pH превышает значение 13 — скорость разложения опять скачкообразно увеличивается. Это происходит из-за увеличения ионной силы раствора, вызванного присутствием сильного избытка щелочи (NaOH). В целом можно использовать за правило — для хлор-содержащих дезсредств используем только щелочную среду. Для пероксидных дезсредств — наиболее эффективна кислая среда. ЧАС-ы несовместимы с кислотами и резко теряют в их присутствии свои дезинфицирующие свойства. Альдегиды (вроде формалина и глутаральдегида) — работают и в кислой, и в щелочной среде)
Примеси: алюминий, медь, никель, железо, кобальт, марганец и т.д. являются катализаторами разложения NaOCl. Металлы в основном катализируют разложение по реакции (A) с образованием газообразного кислорода. Твердые суспензии, такие как, например, частицы графита в гипохлорите натрия, получаемом электрохимическим методом, также вызывают разложение NaOCl, в частности, по реакции (B) с образованием хлората натрия. Кстати, как говорят некоторые производители дезсредств, добавки сульфата магния, силиката натрия, борной кислоты - замедляют распад.
Воздействие света: воздействие света ускоряет процесс разложения NaOCl в растворе. Современные методы упаковки и использование непрозрачных полиэтиленовых бутылок практически исключают влияние света на стабильность растворов. Янтарные или зеленые стеклянные бутылки также имеют такой же результат. Если важны конкретные цифры — получится вот так:
Для предотвращения разложения гипохлорита требуется контейнер, который отсекает свет ниже 475 нм и пропускает менее 2% при 500 нм.
Подводя итог, можно сказать следующее. Самым долгоиграющим будет препарат, который:
- Имеет низкую концентрацию гипохлорита
- 11,5< рН в диапазоне >13
- В котором отсутствуют примеси металлов/графита (=отфильтрованный)
- Хранится при температуре <30°С (=в холодильнике)
- Упакован в абсолютно непроницаемые для света контейнеры
Совместимость материалов
Вопрос совместимости материалов перекликается со сказанным ранее (особенно, относительно металлов). На представленной ниже
таблицеможно даже увидеть с какой скоростью что корродирует.

Здесь же и видно, что вопрос совместимости материалов актуален в основном для случая хранения/перевозки гипохлорита высоких концентраций и рядового «дезинфектора» волновать должен слабо. В общую копилку упомяну еще несколько материалов, которые рекомендуются на роль прокладок/конструкционных материалов при работе с концентрированным гипохлоритом натрия:
- PVDF (фторированный поливинилиден)
- Этиленпропиленовый каучук
- Хлорбутилкаучук
- CPVC (хлорированный поливинилхлорид)
- Тантал
- FRP (стеклопластик с подходящей инертной смолой и системой отверждения)
- Полидициклопентадиен
Американская табличка устойчивости к гипохлориту
Взято
отсюда, буква S = совместимость удовлетворительная (satisfactory), буква U = совместимость неудовлетворительная (unsatisfactory). Табличка кликабельна.

Техника безопасности при работе с гипохлоритом
В целом, типичный (=разбавленный) бытовой отбеливатель вроде белизны не опаснее воды (если с ним уважительно обращаться, бутылочку там подписывать, от детей прятать и т.п.). По статистике, в 2002 году в Великобритании было зафиксировано около 3300 несчастных случаев, связанных с гипохлоритом натрия. И абсолютное большинство из них — употребление дезинфектанта внутрь… Думаю, комментарии излишни.
Что касается гипохлорита натрия «промышленной концентрации», т.е. такого которым очищают сточные воды, то он уже относится к суровому первому классу опасности (класс 1B-поражение кожи + класс 1-поражение глаз).
Если расшифровать — при попадании на кожу и в глаза вызывает химические ожоги. Будет вызывать раздражение и при попадании на слизистые оболочки верхних дыхательных путей (при вдыхании). Отдельного упоминания заслуживает и такой камень преткновения, как «хлорка в воде бассейна».
Как правило, концентрация гипохлорита натрия, присутствующая в плавательных бассейнах абсолютно не вредна для людей. Но! Но дело меняется, если в воде присутствует большое количество мочевины (смесь мочи и пота), и тут уж хлорноватистая кислота и мочевина вступают в реакцию с образованием ядреных хлораминов (о механизме образования — ниже). Именно хлорамины раздражают слизистые оболочки и дают т.н. «запах хлора». В нормальных бассейнах этого быть не должно (нормальный = тот, в котором меняют воду и работает вентиляция). Если же этого не происходит, то постоянное воздействие летучих хлораминов может даже привести к развитию атопической астмы (см.
статью).
Лечение при отравлении:
Учитывая все выше сказанное, решил я прикрепить и небольшую «памятку для врача», чтобы случись что — все было под рукой. Описание действий на случай отравления гипохлоритом натрия. Оно, кстати, примерно такое же, как и в случае отравления щелочью (cкользкое ощущение отбеливателя на коже связано с омылением кожных масел и разрушением тканей). НО! Но это только для чистого гипохлорита натрия. В случае его комбинация с различными бытовыми химикатами — лечить возможно придется от отравления продуктами реакции (см. следующий пункт).

Замечание про «запах хлора»:
часто можно услышать от читателей вопрос «чем убрать этот неприятный запах хлора с рук/полумаски/предметов». В таком случае поможет тиосульфат натрия, притом для активного удаления запаха хватит и раствора с концентрацией около 5 мг/л (0,005%). Промываем этим раствором руки или __ (вписать нужное), а затем промываем водой с мылом. Если же тиосульфата найти не удалось, то остается только проверенный способ — «выветривание запаха со временем».
Кстати, для нейтрализации разливов концентрированного гипохлорита натрия (будем считать что 5% и выше) можно также использоваться сульфит натрия, он работает по реакции:
NaOCl + Na2SO3 → NaCl + Na2SO4
или
гидросульфит натрия, который работает по реакции:
NaOCl + NaHSO3 + NaOH → NaCl + Na2SO4 + H2O
А можно, в случае очень небольшого количества гипохлорита, использовать и перекись водорода, но с осторожностью (!) ибо там выделяется кислород.
Опасное соседство — НЕсовместимая бытовая химия
Гипохлорит натрия, являясь очень активным компонентом, легко вступает в химические реакции (в т.ч. и в фотохимические — т.е. с солнечным светом и ультрафиолетом от популярных ныне бактерицидных ламп). Часто в результате этих реакций выделяется хлор (=серьезный раздражающий агент), например при контакте нашей белизны и средства для очистки от ржавчины. При контакте гипохлорита с соединениями аммиака (в т.ч. с любимыми народом ЧАС-ы, которые сейчас начали добавлять в средства для мытья полов), и даже при контакте с мочой (!) в которой содержится мочевина — могут образовываться токсичные в обычных условиях хлорамины:
NH3 + NaOCl → NaOH + NH2Cl
NH2Cl + NaOCl → NaOH + NHCl2
NHCl2+ NaOCl → NaOH + NCl3
При контакте белизны с некоторыми бытовыми моющими средствами, содержащими ПАВы и различные отдушки могут образовываться летучие (!) хлорорганические соединения, вроде четыреххлористого углерода (CCl
4) и хлороформа (CHCl
3). Классы их опасности каждый может посмотреть сам. Например в
статьеисследователи показали, что при работе с некоторыми «хитрыми» средствами бытовой химии концентрации этих растворителей повышаются в 8–52 раза для хлороформа и в 1–1170 раз для четыреххлористого углерода выше допустимых соответственно. Самый низкий «выхлоп» летучей хлорорганики дает самый простой отбеливатель (читай «белизна»), а вот самый высокий — средства в форме «густой жидкости и геля» (типа всяких там Доместосов и иже с ними, которые и развести толком нельзя). Поэтому, на будущее, а) стоит всячески избегать «суперэффективных средств с новой формулой» (= дерьма, которое разработал менеджер, а не инженер) и придерживаться классической формулы «лучшая белизна = гипохлорит да вода». И б) использовать при уборке квартиры респираторы с угольным фильтром (=«для задерживания паров растворителей»).
С перекисью водорода гипохлорит натрия реагирует достаточно бурно, с образованием хлорида натрия (ваша любимая поваренная соль) и кислорода:
H2O2 + NaOCl → NaCl (водный) + H2O + O2
Гетерогенные реакции гипохлорита с металлами протекают достаточно медленно и дают в результате оксид металла (ну или гидроксид). На примере цинка:
NaOCl + Zn → ZnO + NaCl
С различными комплексами металлов белизна реагирует не в пример быстрее.
Как уже упоминалось, гипохлорит натрия не любит высокую температуру (выше 30°C), и при нагревании распадается на хлорат натрия и кислород (для 5% раствора температура разложения ~40°C), если удастся нагреть до 70°С разложение может протекать со взрывом.
В целом, гипохлорит высоких концентраций негорюч и взрывобезопасен. Но при контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызывать возгорание. Вообще, такая реакционная способность — это одновременно и благо, т.к. вещество не может долго находится в неизменном состоянии в окружающей среде и быстро дезактивируется (=можно просто смыть в сточные воды).
В качестве выводов — все написанное выше сведено в единую таблицу несовместимых компонентов (кликабельна).

Некоторые из этих соединений можно найти в бытовых, автомобильных и промышленных химикалиях и смесях химикалий = средства для чистки окон, унитазов и поверхностей, обезжиривающие средства, антифризы, средства для очистки воды, химия для бань и бассейнов. Поэтому чаще смотрите на этикетку. Требуйте, чтобы на этикетке писали состав! Покупайте только то средство, где на этикетке есть максимальная информация о составе. Пора уже голосовать рублем за адекватное отношение к покупателю.
Практикум или Вся Белизна Минска
Полностью разобравшись с теорией, теперь мы подходим к самому интересному. К лабораторным занятиям. Как и обещал читателям, я проехался по Минску и собрал все доступные варианты жидкого отбеливателя (именно жидкого, на гели и т.п. я даже не смотрел). Теперь же я хочу рассказать как я их сравнивал и «проверял на вшивость» (= подходят ли они для целей дезинфекции).
Кстати, отмечу, что все описанные в статье методы вполне себе работоспособны в мирное время, для проверки качества воды в бассейнах или кранах. Если вдруг у кого-то возникнет желание сказать «вода плохая - воняет хлоркой» , то после прочтения статьи, надеюсь, это можно будет сделать без проблем. А нынче, нынче вода с хлоркой это благо во время пандемии…
В общем, первым делом подбираем себе необходимые СИЗ (по желанию). Как я уже упоминал выше, для большинства задач (и прямых рук) достаточно перчаток. Не зная что в бутылках за смеси, я решил перестраховаться и использовать полный комплект защиты (только со своей полумаски 3М 7502 «коронавирусные» противоаэрозольники 6035 я заменил на угольные патроны класса «газы/пары» — типа ABE1, как в моем случае, или лучше ABEK1. Пойдут и отечественные противогазные коробки и респираторы для работы с парами растворителей.
выбор фильтров для работы с бытовой химией (кликабельно)

С предварительными приготовлениями разобрались, и теперь я представляю вашему вниманию всю Белизну Минска! Встречайте беларуских красавиц! Это, кстати, все что удалось найти в гипермаркетах города-героя.

Первым делом я оценил внешний вид, т.е. цвет и консистенцию предлагаемых растворов. Хотя ожидать здесь чего-то экстраординарного не приходится (т.к. по условиям задачи — никаких гелей и прочего «химо-фарша», максимальная простота).
Потом измерил их плотность (кликабельно) + рН, он же водородный показатель.

Плотность измеряем вот такими советскими ареометрами да стеклянным цилиндриком

А рН, рН — уж чем бог пошлет (вплоть до индикаторных бумажек, но учитывайте что краситель в бумажках будет моментально «выгорать» и обесцвечиваться). В моем же дорожном чемоданчике случайно завалялись рН-метры Hanna:

В результате получилась вот такая сводная таблица с данными (кое-что пришлось переписать с этикеток):
Отдельно напишу состав (т.е. то, что там есть еще КРОМЕ гипохлорита натрия, это важно, особенно учитывая всякие хлорамины и летучую хлорорганику, о которых я писал выше). Стиль написания сохранен, чтобы читатель понимал, кто пишет инструкции.
образец 1. Вода, анионный ПАВ – менее 5%, стабилизатор, комплексообразователь
образец 2. Вода
образец 3. Вода, НПАВ менее 5 (%), ароматизатор (свежесть) –менее 5%
образец 4. Вода, анионный ПАВ – менее 5%, стабилизатор, комплексообразователь
образец 5. Вода, щелочь – менее 5%, вода 30% и более
образец 6. <5% щелочь, вода, отдушка
образец 7. Более 30% вода питьевая, трилон Б, натрия гидроксид – менее 5%
Возможно «в рамках факультатива» я когда-нибудь сделаю анализ гелей с активным хлором. Но такая форма очень неудобна по нескольким причинам. Во-первых в составе могут быть взаимоисключающие компоненты (см. таблицу несовместимости) и при открывании бутылки вы сразу начнете получать дозу хлора/хлорамина и т.п. Во-вторых из-за кучи добавок не совместимых с человеческим организмом — гели нельзя использовать для той же дезинфекции воды. Ну и в третьих, высокая вязкость раствора не позволит его ни развести нормально, ни использовать в комбинации с распылителем (например, для орошения ручек дверей).
Ну и наконец с подготовительным этапом закончили, теперь самое важное и интересное — концентрация гипохлорита натрия. Важна она потому что именно к этому показателю привязываются все рекомендации по дезинфекции. Ну а сами производители не идут навстречу покупателю и пишут черт-те что (cм. далее). Хотя узнать, сколько там гипохлорита не так уж и сложно. Поможет в этом такая методика, как титрование. Мы будем просто добавлять один компонент до тех пор, пока он полностью не прореагирует со вторым (сигнализировать об этом будет изменение цвета раствора). Для определения активного хлора в гипохлорите можно применить отечественную ГОСТ-овскую методику, а можно применить американскую АSTM.
Отличие аналитических реакцийВ отечественном методе используется серная кислота и реакция:
NaClO + 2KI + 2H2SO4 → NaCl + I2 + K2SO4 + H2O
В американском методе используется уксусная кислота и реакция:
NaOCl + 2KI + 2CH3COOH → I2 + NaCl + 2KC2H3O2 + H2O
И в том, и в том методе выделившийся иод определяют титрованием тиосульфатом натрия.
В принципе, разницы по которой работать я лично не вижу, здесь играет роль доступность реагентов, я использовал ГОСТ-скую, т.к. серная кислота не так воняет как уксусная.

Метода
ГОСТ Р 57568-2017(упрощенная):
Для работы нам нужны следующие компоненты:
1)Серная кислота 1н.
Отмеряем 28,6 мл концентрированной серной кислоты (плотность = 1, 84 г/см3) и доводим до литра дистиллированной водой.
2)10 % раствор иодида калия
Взвешиваем 10 грамм иодида калия и растворяем в 90 мл дистиллированной воды. Раствор применяется свежеприготовленный
3)Раствор тиосульфата натрия 0.1н
Взвешиваем 25 г тиосульфата натрия (пентагидрата) и доводим дистиллированной водой до 1 л. Хранить в темной бутылке.
4)Раствор крахмала 1%
Взвешиваем 1 г крахмала (кукурузного, картофельного и т.п., хоть картошку натирайте и заваривайте, но! но не забудьте профильтровать :) ) и размешиваем с 10 мл дистиллированной воды. Затем кипятим в стакане 90 мл дистиллированной воды и когда закипела — вливаем наши 10 мл с крахмалом. Варим, перемешивая 2-3 минуты. Используем свежеприготовленным.
Сама процедура проверки следующая. Отбираем образец гипохлорита объемом 10 мл, и доводим водой до 250 мл. Отбираем из этого объема 10 мл и переносим в стакан, в этот же стакан добавляем 10 мл раствора иодида калия и 20 мл серной кислоты. Хорошо перемешиваем и ставим в темноту на 5 минут. По прошествии 5 минут капаем по каплям (из калиброванной капельницы, а еще лучше бюретки) раствор тиосульфата натрия пока раствор красного цвета (из-за выделившегося иода) не станет прозрачным.

устал от заводской бюретки и достал свой дорожный вариант

Когда жидкость приобретет соломенный (светло-желтый) цвет — доливаем в стакан 2-3 мл крахмала, раствор синеет.
вот так он синеет
Теперь потихоньку добавляем тиосульфат пока синий цвет не исчезнет.
Какие могут быть нюансы, влияющие на результат определения? А вот следующие (советую их держать в уме).
- Недостаточное количество иодида калия (= при приготовлении раствора вы использовали старый полуразложившийся реактив) добавленного к образцу приведет к тому, что прореагирует не весь гипохлорит и показатели активного хлора будут занижены. Поэтому лучше небольшой избыток иодида.
- Плохое перемешивание иодида калия с гипохлоритом даст ту же ошибку, что и в предыдущем пункте. Поэтому очень хорошо перетрясите смесь растворов.
- Готовить впрок раствор иодида калия нет смысла — его нужно использовать свежеприготовленным. При хранении в растворе иодид будет разрушаться, и в итоге давать заниженный показатель активного хлора.
- Добавление кислоты до внесения раствора иодида приведет к потере определенной доли свободного хлора. Поэтому важно соблюдать упомянутый мной порядок: сначала иодид, потом кислота.
- Титрование без добавления крахмала. Человеческий глаз слабо чувствителен к изменениям желтого цвета, что может привести к ошибкам и низкой точности полученных результатов.
- Слишком раннее добавление крахмала приведет к необратимой реакции крахмала с йодом (образование красноватой окраски) и вам попросту не удастся отследить конец реакции. Добавляем крахмал когда цвет раствора соломенный (светло-желтый), а не красноватый.
- Использование старого тиосульфата натрия. Этот реактив в растворе склонен к разложению (поэтому его нужно хранить в темной бутылке, вдали от солнечных лучей). Как вариант, либо каждый раз готовить свежий раствор, либо проверять существующий и вносить соответствующие поправки (первое — рекомендуется).
Во время нашего титрования подсчитываем количество капель, которое пошло на нейтрализацию гипохлорита и рассчитываем массовую концентрацию активного хлора по формуле:
Х=(Объем тиосульфата*0,003545*250*1000)/100.
для фанатов всего американского :)
Все реактивы, за исключением уксусной кислоты — готовятся по идентичному ГОСТ-овскому методу (п.2-п.4 основной методики). Уксусная кислота (=замена серной кислоты из п.1) для «титрования по американски» готовится растворением 500 мл ледяной уксусной кислоты в 500 мл воды.
Подготовка пробы: отбираем 25 мл исследуемого гипохлорита натрия, переносим в 250 мл колбу/стакан и взвешиваем на весах с точностью до 0,01 грамма. Затем доводим дистиллированной водой до метки в 250 мл. Хорошо перемешиваем. Затем отбираем из этой колбы/стакана 10 мл раствора и переносим в новую колбу/стакан на 250 мл. Добавляем туда 50 мл дистиллированной воды, мешаем, добавляем 25 мл 10% раствора иодида калия и опять мешаем. Раствор приобретает красно-коричневый цвет (см. картинку выше). Добавляем 10 мл нашего раствора уксусной кислоты. Опять мешаем 3-5 минут. Затем титруем, по каплям добавляя раствор 0,1 н. раствор тиосульфата натрия. Считаем объем тиосульфата, который на это идет. После того, как раствор приобретает соломенно-желтую окраску, добавляем 5 мл раствора крахмала и острожно, по капле добавляем в посиневший (см. картинку выше) раствор тиосульфат. Когда синий цвет исчез и раствор стал прозрачным — титрование закончено. Записываем потраченный объем тиосульфата натрия. Концентрация гипохлорита натрия рассчитывается по формуле:
% NaOCl = (Объем потраченного тиосульфата натрия*N*3,723722)/0,04*масса образца гипохлорита
N — нормальность раствора тиосульфата, у нас она 0,1
В результате титрования моих образцов получилось следующее (в скобках концентрация гипохлорита, которая считается по формуле: концентрация гипохлорита (NaOCl) = концентрация хлора*1,05:
образец 1. хлор 19.32 г/л = (NaOCl 20, 29 г/л) = 2,029 % раствор
образец 2. хлор 5.67 г/л = (NaOCl 5, 96 г/л) = 0,596 % раствор
образец 3. хлор 32.26 г/л = (NaOCl 33, 87 г/л) = 3,387 % раствор
образец 4. хлор 21.27 г/л = (NaOCl 22, 33 г/л) = 2,233 % раствор
образец 5. хлор 20.74 г/л = (NaOCl 21, 76 г/л) = 2,176 % раствор
образец 6. хлор 18.97 г/л = (NaOCl 19, 91 г/л) = 1,991 % раствор
образец 7. хлор 14.18 г/л = (NaOCl 14, 89 г/л) = 1,489 % раствор
Т.е. если считать что крайняя «короноубойная» концентрация гипохлорита натрия = 0,5%, то выходит что растворы нужно разбавлять в: 4 раза (средство 1, средство 6), 4,4 раза (средство 5) 4,5 раза (средство 4), в 7 раз нужно разбавлять средство 3. Средство 7 разбавляем в 3 раза, а средство 2 — вообще разбавлять не нужно (вот вам и прозрачная тара). Напоследок — фото с победителем:
Гомельский ОДО БУДМАШ! Хабра-привет вам и respect за вашу продукцию :).
На закуску покажу как полученные экспериментальные данные коррелируют с писаниной на этикетке:
образец 1. «гипохлорит натрия – 30% и более» = 2,029 %
образец 2. «гипохлорит натрия (5% или более, но не менее 15%) = 0,596 %
образец 3. «гипохлорит натрия 30 (%) и более» = 3,387 %
образец 4. «гипохлорит натрия – 30% и более» = 2,233 %
образец 5. «гипохлорит натрия – 5% и более, но менее 15%» = 2,176 %
образец 6. «<30% натрия гипохлориД» = 1,991 %
образец 7. «15% или более, но менее 30% натрия гипохлорит» = 1,489 %
Ответ — никак. Полный рандом. Так что здесь совет даже не «Доверяй, но проверяй!», а просто «Сразу проверяй, проверяй, проверяй!»
Что ж делать тем, кому титрование не по душе (хотя имхо — это самый простой и доступный даже в далекой деревне вариант, знай себе, только капли считай). Таким людям могут помочь специальные тест-полоски Дезиконт-ГН-01 (индикаторные полоски для экспресс-контроля концентраций рабочих растворов дезинфицирующего средства «Гипохлорит натрия»). Которые найти наверное гораздо сложнее, чем этанол в эпоху пандемии коронавируса :)

Можно попробовать прикинуть определить концентрацию и по температуре замерзания (чем она ниже — тем концентрированней гипохлорит).
Можно измерить поверхностное натяжение, вязкость или проводимость раствора (TDS-метром с алиэкспресс, ага). Для 1% раствора NaOCl поверхностное натяжение = 75 дин/см, вязкость = 0,968 сантипуаз, проводимость = 65,5 миллисименс. Но корреляции на большую/меньшую концентрацию оооччееень условны и зависят от множества факторов.
Некоторым подспорьем, в случае отсутствия реагентов для титрования может оказаться сводная таблица корреляции плотности/избытка щелочи с концентрацией гипохлорита (правда только в случае, если концентрация >4%, что в наших краях возможно только если покупать промышленный гипохлорит используемый для нужд водоканалов, ибо белизна — сами видите, какая белизна):
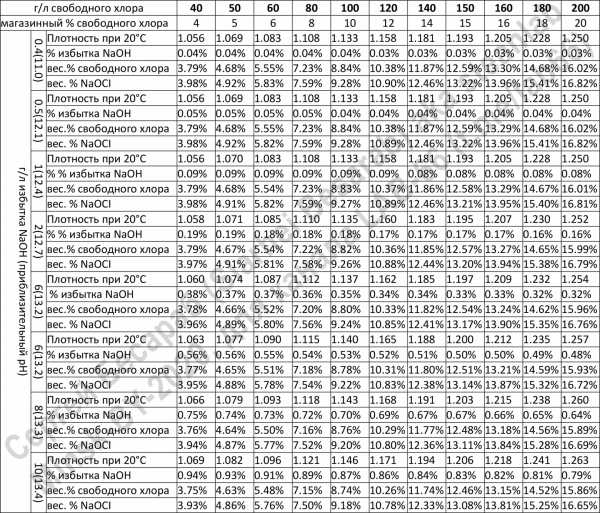
Кстати, допустим вы определились с необходимой для дезинфекции концентрацией, и с концентрацией купленной белизны, но… Но внезапно не знаете как развести ваше средство (фантастический, имхо, сценарий, но мало ли что, мы рождены ж чтоб сказку сделать былью). Для решения такой задачи вам понадобится пойти по ссылке "калькулятор разбавления растворов" и вписать туда нужные цифры. В качестве примера, возьмем нашего победителя, 1 литр белизны с концентрацией гипохлорита натрия 3,387 % от гомельского Будмаш и разведем до 0,5%, чтобы «помыть полы от коронавируса». Калькулятор нам пишет — нужно добавить 5,774 литра воды («растворителя»).

Как видите, ничего сложного. Обеззараживайтесь! :)
Краткие выводы
- Гипохлорит натрия — это замечательный многофункциональный дезинфицирующий (и даже моющий) агент, это «химический швейцарский нож». Пригодиться он может не только в случае коронавируса, но и при обеззараживании питьевой воды, для удаления плесени и грибков и даже для удаления чайного налета с кружек. Но стоит помнить, что гипохлорит натрия и хлорсодержащие соединения проявляют наибольшую активность только в щелочной среде
- При работе с гипохлоритом стоит использовать не только перчатки, но и угольные респираторы (особенно для новомодных гелей и т.п., выдающих потенциально канцерогенные пары)
- На этикетках продающихся в магазинах отбеливателей пишут лишь бы что (надеюсь, коронавирус это исправит). И в случае дефицита дезсредств — надеяться можно только на свою голову и инструкцию из статьи. Пока же, чемпион по содержанию NaOCl в Беларуси — Белизна гомельского завода Будмаш.
- Раздражаюший запах хлора с предметов (после протирания/орошения гипохлоритом) можно убрать а)проветриванием б)обработкой растворами тиосульфата натрия, сульфита натрия, гидросульфита натрия или перекиси водорода.
Disclaimer
: вся информация, изложенная в статье, предоставлена сугубо с информационными целями и не является прямым призывом к действию. Все манипуляции с химическими реактивами и оборудованием вы проводите на свой страх и риск. Автор не несет никакой ответственности за небрежное обращение с агрессивными растворами, безграмотность, отсутствие базовых школьных знаний и т.п. Если не чувствуете в себе уверенности понять написанное — попросите проконтролировать ваши действия родственника/друга/знакомого который имеет хотя бы какое-то техническое образование (=«в школе неплохо учился»). Постарайтесь использовать СИЗ и максимально соблюдать технику безопасности. И да,
обязательно убирайте домашних животныхво время обработки! И если сами не моете свои руки 0,5% гипохлоритом натрия, то не делайте это и для лап своей собаки!
На этом все! Традиционно, предлагаю подписаться на мой научно-технический канал и подключаться к обсуждению!
Грантовая поддержка исследованияФактически, в роли «научного грантодателя» для этой статьи выступают мои «меценаты» с Patreon. Благодаря им все и пишется. Поэтому и ответ они могут получить раньше всех других, и черновики увидеть, и даже предложить свою тему статьи. Так что, если интересно то, о чем я пишу и/или есть что сказать — поспешите стать моим «патроном» (картинка кликабельна):
Список использованных источников
• Ronco, C. Mishkin, G.J. Disinfection By Sodium Hypochlorite Dialysis Applications/Nephrology, 2007, Vol. 154.
• Jeffrey M. Levine Dakin’s Solution: Past, Present, and Future /Advances in Skin & Wound Care: The Journal for Prevention and Healing, 2013,volume 26, issue 9, pages 410–414
• D. N. Herndon, and M. C. Robson Bactericidal and Wound-Healing Properties of Sodium Hypochlorite Solutions: The 1991 Lindberg Award/Journal of Burn Care & Rehabilitation, 1991, volume 12, issue 5, pages 420–424.
• L. Wang; et al. Hypochlorous Acid as a Potential Wound Care Agent/Journal of Burns and Wounds, 2007, 6: e5
• Sandin, Rasmus K. B. Karlsson, and Ann Cornell Catalyzed and Uncatalyzed Decomposition of Hypochlorite in Dilute Solutions/Industrial Engineering Chemical Research, 2015, volume 54, issue 15, pp. 3767–3774.
• Daniele S. Lantagne Sodium hypochlorite dosage for household and emergency water treatment/ e-Journal AWWA. 2008, 100 (8).
• Rutala, William A., Weber, David J. Guideline for Disinfection and Sterilization in Healthcare Facilities" (PDF).
www.cdc.gov. [2008]
• J. P. Heggers, J. A. Sazy, B. D. Stenberg, L. L. Strock, R. L. McCauley, D. N. Herndon, and M. C. Robson Bactericidal and Wound-Healing Properties of Sodium Hypochlorite Solutions: The 1991 Lindberg Award"/Journal of Burn Care & Rehabilitation, 1991, volume 12, issue 5, pp. 420–424.
Root Canal Irrigants and Disinfectants
. Endodontics: Colleagues for Excellence. Published for the Dental Professional Community by the American Association of Endodontists. 2011. —
• Hülsmann, M.; Hahn, W.
Complications during root canal irrigation – literature review and case reports" (PDF). International Endodontic Journal. 2000, 33 (3): 186–193. —
• Odabasi, Mustafa Halogenated Volatile Organic Compounds from the Use of Chlorine-Bleach- Containing Household Products/Environmental Science & Technology. 42 (5): 1445–1451.
• Jones, F.-L. Chlorine poisoning from mixing household cleaners/J. Am. Med. Assoc. 1972, 222 (10)
• Minimizing Chlorate Ion Formation in Drinking Water when Hypochlorite is the Chlorinating Agent, American Water Works Association (AWWA) Research Foundation, G. Gordon and L. Adam, Miami University, Oxford, OH & B. Bubnis, Novatek, Oxford
• Emergency Response Plans for Chlor-Alkali, Sodium Hypochlorite, and Hydrogen Chloride Facilities, ed. 7; Pamphlet 64; The Chlorine Institute: Arlington, VA, 2014.
Автор выражает благодарность своему главному ассистенту — научному сотруднику Юстыне за помощь в испытаниях беларуских гипохлоритов и моей украинской parteigenosse Саше aka infiltree за ____ (впиши сама, ок?) :).Благодарю всех администраторов своего канала, которые провели (и проводят даже сейчас) огромную разьяснительную работу, с невероятной выдержкой, раз за разом объясняя людям какие СИЗ можно использовать, чем дезинфицировать, какой нужен спирт, даже какого размера вирион коронавируса. Ребята — S Sh, Воля, O! Пусть мы не заметны в этом информационном шуме — низкий вам поклон от steanlab. Хотя бы со страниц хабра! В это тяжелое время -Vivat комьюнити LAB-66!
Благодарю всех читателей, которые поддерживают наш канал своими донатами! Без вас ничего бы не вышло!!! Надеюсь я не слишком затянул с написанием, и правильную Белизну еще можно будет найти в магазинах.
Важно! Если информация из статьи пригодилась вам в жизни, то еще не поздно:
Стать спонсором и поддержать канал/автора (=«на реактивы»)!
Перевод Киви (QIWI) 79176005394
ЯндексДеньги: 410018843026512 (перевод на карту)
WebMoney: 650377296748
BTC: 3QRyF2UwcKECVtk1Ep8scndmCBoRATvZkx
Ethereum (ETH): 0x3Aa313FA17444db70536A0ec5493F3aaA49C9CBf
Patreon — steanlab
Наставничество
Практическая часть
«Определение необходимости света для зеленого растения»
Оборудование: цветочные горшки, земля, картонный ящик, семена томатов, вода.
Заполнила два цветочных горшка огородной землей, посадила в них по два семени томата. Когда у растения появилось 4 настоящих листа, я прикрыла одно из них картонным ящиком, а другое оставила открытым на свету. Растения регулярно поливала. Через две недели сняла ящик и обнаружила, что растение под коробкой сильно вытянулось и листья его пожелтели.
Я сделала вывод: растение тянется к свету, а это значит, что для роста растений нужен свет, так как растение усваивает солнечную энергию.
«Образование крахмала в листьях на свету»
Оборудование: растение – герань, штатив, спиртовка, вода, спирт, пинцет, скрепки.
Техника безопасности: соблюдать осторожность при работе со спиртовкой, спиртом, горячей водой, чтобы не вызвать ожоги!
У комнатного растения герани, стоявшего на свету, оторвала один лист и опустила его на 5 минут в чашку с кипящей водой. Затем положила лист в стаканчик с небольшим количеством спирта, который поставила в кипящую воду.
Зеленая окраска листа (хлорофилл) растворяется в спирте. Когда лист обесцветился, его ополоснула в воде и опустила в раствор йода (цвет крепкого чая), налитого в блюдце. Я увидела, что лист посинел. Вывод: значит в листе есть крахмал, который в присутствии йода окрашивается в синий цвет.
Затем я продолжила опыт. На этом же растении на один из листочков с двух сторон в одном месте я, с помощью скрепок, прикрепила одинаковые фигуры, вырезанные из картона и поставила растение на свет на 3 дня, предварительно полив его. Затем провела тот же эксперимент, предложенный выше, я увидела, что, то место, которое было закрыто картоном в растворе йода, не окрасилось, а та часть листа, которая была открыта солнечным лучам окрасилась в фиолетовый цвет. Я пришла к выводу, что на свету в растении, в зеленых листьях, образуется крахмал.
Примечание: йод является качественной реакцией на крахмал.
«Значение хлорофилла в питании растения»
Оборудование: растение - хлорофитум пестролистный, штатив, спиртовка, вода, спирт, пинцет.
У хлорофитума пестролистного, стоявшего на свету, оторвала один лист и опустила его на 5 минут в чашку с кипящей водой. Затем положила лист в стаканчик с небольшим количеством спирта, который поставила в кипящую воду.
Зеленая окраска листа (хлорофилл) растворяется в спирте. Когда лист обесцветился, его ополоснула в воде и опустила в раствор йода (цвет крепкого чая), налитого в блюдце. Я увидела, что лист посинел не по всей поверхности, а только там, где он зеленый, а белые полоски на листе остались бесцветными.
Вывод: крахмал образуется только в зеленой части листа.
«Определение выделения кислорода и поглощение углекислого газа зелеными растениями»
Оборудование: стеклянная банка, воронка, пробирка, вода, водное растение элодея из аквариума, лучинка, раствор пищевой соды.
В стеклянную банку налила воду. Скальпелем отрезала две веточки элодеи, поместила в воронку, (отрезанным концом к узкому краю воронки) и широким концом воронку поместила на дно банки. Узкий конец воронки должен быть покрыт водой на 2 – 3 см. В пробирку налила воду и, закрыв пробирку пальцем, опустила вверх дном в банку, под водой убрала палец (открыла пробирку) и надела её на узкий конец воронки. Опыт поставила на свет. Через несколько часов увидела, что из воронки в пробирку начал выделяться газ. Когда газа в пробирке набралось на 2/3, я аккуратно сняла пробирку с воронки так, чтобы отверстие пробирки находилось под водой. Под водой же закрыла пробирку пальцем, вынула её из воды, перевернула. Затем зажгла лучинку, погасила её и, когда она образовала тлеющий уголек на конце, открыла пробирку и ввела в неё лучинку с тлеющим угольком. Лучинка вспыхнула ярко.
Вывод: В пробирке скопился кислород, потому что, только он поддерживает горение.
Подгруппа углерода лабораторная по химии
ЛАБОРАТОРНАЯ РАБОТА № 1 ТЕМА: ”ПОДГРУППА УГЛЕРОДА” Опыт № 1. Получение углерода термическим разложением древесины Оборудование и реактивы: Штатив с лапкой, спиртовка, спички, резиновые прокладки, сосуд Ландольта, пробка со вставленной в нее стеклянной трубкой, синий лакмус, химический стакан, стружки сухого дерева. Ход работы: Одно колено сосуда Ландольта заполняют плотно сухими стружками. Закрепляют прибор в штативе. Другое колено опускают в стакан с холодной водой. Равномерно прогрев весь сосуд, сильно нагревают стружки. Из стеклянной трубки выходит белый дым, его поджигают. Во втором колене собирается желтоватая смесь, состоящая из воды и жидких органических веществ. Нагревают до тех пор стружки, пока они не обуглятся и не прекратится выделение газов. Затем дают сосуду остыть, открывают пробку и высыпают уголь. Жидкостью из второго колена сосуда Ландольта пропитывают синюю лакмусовую бумагу. Покраснение лакмусовой бумаги свидетельствует о наличии в смеси кислоты. Рис. 22. Термическое разложение древесины. Техника безопасности: Перед нагреванием стружек равномерно прогреть Опыт № 3. Взаимодействие углекислого газа со щелочью Оборудование и реактивы: Аппарат Киппа, цилиндр, лучинка, спички, раствор соляной кислоты (1:2), мрамор, раствор гидроксида натрия (конц.), шпатель. Ход работы: Заряжают аппарат Киппа на получение углекислого газа. В цилиндр без носика наливают 15-20 мл концентрированного раствора гидроксида натрия и опускают газоотводную стеклянную трубку от аппарата Киппа до поверхности раствора, но не в раствор. Открывают зажим и дают сильный ток углекислого газа, чтобы быстро вытеснить весь воздух. Затем вынимают трубку из цилиндра и перекрывают ток углекислого газа. Цилиндр быстро закрывают ладонью и слегка покачивают. Углекислый газ реагирует с гидроксидом натрия. В цилиндре возникает разрежение, давление падает, ладонь плотно прижимается к отверстию цилиндра. Демонстрируют подъем цилиндра открытой ладонью руки. Протекает химический процесс: CO2 + 2NaOH F 0A E Na 2CO3 + h3O Чтобы убедиться в образовании карбонатов, в цилиндр по стенке осторожно приливают раствор соляной кислоты. Происходит вспенивание - активное выделение углекислого газа. Техника безопасности: 1. Не допускать попадания газа в атмосферу класса. 2. Концентрированную щелочь приливать в цилиндр под тягой. 3. Соблюдать технику безопасности при зарядке аппарата Киппа. Рис. 25. Взаимодействие CO2 с концентрированным раствором едкого натра. Утилизация: Отработанную соляную кислоту в аппарате Киппа утилизировать по схеме, описанной в теме: “Вода. Растворы. Основания,” VIII класс, опыт № 8. Раствор щелочи с примесью карбоната натрия использовать многократно. При значительном насыщении раствора карбонатом натрия, содержимое перенести в емкость-нейтрализатор. Опыт № 4. Получение оксида углерода (IV) и изучение его свойств Оборудование и реактивы: Две пробирки, пробка со вставленной в нее газоотводной трубкой, мрамор, соляная кислота (1:5), известковая вода, разбавленный раствор гидроксида натрия, фенолфталеин, лакмус, шпатель. Ход работы: В пробирку поместить несколько кусочков мела или мрамора и прилить разбавленный раствор соляной кислоты. Закрыть пробирку пробкой с газоотводной трубкой. Пропустить выделившийся углекислый газ в пробирки: а) с водой, подкрашенной раствором лакмуса; б) с известковой водой: CO2 + Ca (OH)2 F 0A E CaCO3 + h3O в) с раствором щелочи и несколькими каплями фенолфталеина: 2NaOH + CO2 F 0A E Na2CO3 + h3O Объяснить наблюдаемые явления. Утилизация. Перенести содержимое щелочных растворов в емкость– нейтрализатор. Содержимое пробирки-реактора утилизировать по схеме, описанной в теме: “Вода. Растворы. Основания”, VIII класс, опыт № 8. Опыт № 5. Распознавание карбонатов Оборудование и реактивы: Штатив с пробирками, разбавленные растворы углекислого натрия, хлорида бария, нитрата серебра, азотной кислоты, соляной кислоты, мрамор, шпатель. Ход работы: 1. В пробирку налить раствор углекислого натрия объемом 1 мл и прилить раствор хлорида бария такого же объема. Образуется белый осадок карбоната бария BaCO3. Na2CO3 + BaCl2 F 0A E BaCO3↓ + 2NaCl К осадку прилить раствор соляной кислоты. Осадок растворится. 2. В пробирку налить раствор углекислого натрия объемом 1 мл и прилить несколько капель раствора нитрата серебра. Образуется осадок: Na2CO3 + 2AgNO3 = 2NaNO3 + Ag2CO3↓. К осадку прилить разбавленный раствор азотной кислоты малыми порциями до полного его растворения. Ag2CO3↓ + 2HNO3 F 0A E 2AgNO3 + h3O + CO2 F 0 A D 3. К кусочку мела или мрамора прилить несколько капель соляной кислоты. Объяснить наблюдаемые явления и написать уравнения реакций. Утилизация. Содержимое пробирки с соединениями бария перенести в нейтрализатор. К содержимому пробирки с соединениями серебра поднести универсальную индикаторную бумагу. Если среда сильнокислая, то раствор можно использовать повторно для обнаружения хлорид–ионов. Если среда слабокислая - использовать повторно в этом же опыте. Опыт № 6. Ознакомление со свойствами карбонатов и гидрокарбонатов Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, спиртовка, спички, пробирки, пробка со вставленной в нее газоотводной трубкой, гидрокарбонат натрия (порошок), известковая вода, шпатель. Рис. 27. Получение кремневой кислоты. Техника безопасности: Быстро вымыть пробирку с гелем кремневой кислоты во избежание его затвердевания. Утилизация. Содержимое пробирок в опыте № 8 и 9 сливают в раковину, в них отсутствуют токсичные вещества. Отработанную соляную кислоту в аппарате Киппа утилизируют по схеме в теме: “ Вода. Растворы. Основания.”, VIII класс, опыт № 8. ЛАБОРАТОРНАЯ РАБОТА № 2 ТЕМА: ”МЕТАЛЛЫ” Опыт № 1. Электролиз раствора хлорида меди CuCI2 Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, U- образная трубка, выпрямитель, угольные электроды, 5 % раствор хлорида меди, раствор крахмального клейстера, 5% раствор KI. Ход работы: Опыт проводят в U-образной трубке с угольными электродами (рис. 28). В U-образную трубку наливают раствор хлорида меди, в каждое колено трубки помещают угольный электрод и герметично закрывают. Включают ток от аккумулятора или от сети через выпрямитель (U=10В). Через 2-3 мин. на катоде появляется налет меди. Пипеткой взять жидкость из анодной части U-образной трубки и добавить к ней несколько капель раствора KI и крахмала (предварительно отключить прибор от электропитания). Рис. 28. Электролиз раствора хлорида меди. Наблюдается изменение окраски на синий цвет. Написать уравнения процессов, объяснить наблюдаемые явления. Техника безопасности: 1. Не допускать попадания хлора в атмосферу класса. 2. Разбирать прибор под тягой при получении больших количеств хлора. 3. С электроприбором работать, не касаясь оголенных проводов. Утилизация. При описанной методике выполнения опыта раствор хлорида меди можно использовать многократно. Опыт № 2. Электролиз раствора йодида калия Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, U- образная трубка, выпрямитель, угольные электроды, 5 % раствор йодида калия, крахмал, фенолфталеин. Ход работы: Прибор такой же, как в опыте №1. В U-образную трубку наливают раствор йодистого калия и опускают угольные электроды. Включают ток от сети через выпрямитель. По окончании электролиза из трубки, где находится катод, взять пипеткой пробу на щелочь с фенолфталеином. Появляется малиновая окраска. Из трубки, где находится анод, отбираем пипеткой пробу раствора на обнаружение иода с крахмалом. В присутствии йода крахмал синеет. Объяснить наблюдаемые явления, написать уравнения реакций. Утилизация. Раствор иодида калия приобретает коричневую окраску от растворенного в нем йода. Использовать его повторно не представляется возможным. Полученную смесь нейтрализуют несколькими каплями раствора соляной кислоты (контроль по лакмусовой бумаге). Используют раствор для обнаружения непредельных углеводородов, а также для получения йода: 2KI + Cl2 F 0A E 2KCl + I2 F 0 A F. Для получения прозрачного раствора иодида калия к смеси из U-образной трубки добавляют порошок цинка и сильно встряхивают: Zn + I2 F 0A E ZnI2. Избыточной порошок цинка отфильтровывают. Полученный раствор смеси иодида калия и иодида цинка можно использовать для демонстрации процесса электролиза. Опыт № 5. Электрохимическая коррозия 1. Оборудование и реактивы: Штатив с пробирками, раствор серой кислоты (1:5), цинк (гранулы), медная проволока, шпатель. Ход работы: В пробирку на 1/3 объема наливают раствор серной кислоты и помещают одну гранулу цинка. Наблюдают выделение газа водорода. Далее дотрагиваются до цинка медной проволокой. Реакция идет более энергично, выделяются более крупные пузырьки газа. Написать соответствующие уравнения реакций, объяснить наблюдаемые явления. Утилизация. Использовать раствор серной кислоты в следующем опыте. 2. Оборудование и реактивы: Штатив с пробирками, раствор серой кислоты (1:5), цинк (гранулы), раствор сульфата меди массовой долей 5 %. Ход работы: В пробирку наливают раствор серной кислоты и помешают гранулу цинка. Наблюдают выделение газа водорода. Затем в эту пробирку приливают раствор сульфата меди. Идет бурное выделение пузырьков газа. Написать соответствующие уравнения реакций, объяснить наблюдаемые явления. Утилизация: Оставить содержимое пробирки до полного обесцвечивания раствора: Zn + CuSO4 F 0A E Cu + ZnSO4. Отделить фильтрованием кусочек цинка с осевшей на нем медью. Промыть, высушить медь и цинк. В фильтрат (h3SO4 и ZnSO4) добавить оксида, гидроксида или карбоната цинка до прекращения их растворения в кислоте. Избыток твердых веществ отделить от раствора сульфата цинка и использовать реактивы в лаборатории. 3. Оборудование и реактивы: Химический стакан на 200 мл, крышка со вставленными в нее электродами (медным и цинковым), гальванометр, раствор серной кислоты (1:5). Рис. 29. Электрохимическая коррозия цинка в кислой среде. Ход работы: В стакан наливают раствор серной кислоты и накрывают крышкой с электродами (медный и цинковый), соединяют электроды с гальванометром, стрелка гальванометра отклоняется. Описать все происходящие процессы, написать уравнения реакций. Утилизация. Раствор серной кислоты использовать многократно. 4. Оборудование и реактивы: Два химических стакана, медный и цинковый электроды, марлевый жгутик, гальванометр, растворы хлорида меди и хлорида цинка (10 %.) Ход работы: В один стакан наливают 10 % раствор хлорида меди, в другой – раствор хлорида цинка. В первый стакан помещают медный электрод, а во второй – цинковый. Соединяют их гальванометром. Растворы солей соединяют марлевым жгутиком, смоченным электролитом. Описать все происходящие процессы. Написать уравнения реакций. Рис. 30. Медно-цинковый гальванический элемент. Электрохимическая коррозия цинка. Примечание: Марлевый жгутик не должен касаться электродов, для этого оба или слабо представлена синяя окраска). Объяснить наблюдаемые явления, выразить процессы уравнениями реакций. Техника безопасности. С электроприбором работать, не касаясь оголенных проводников. Утилизация. Раствор из U-образной трубки слить в нейтрализатор. Опыт № 9. Коррозия железа Оборудование и реактивы: 5 стаканов на 50 мл, 5 лабораторных пробирок, 5 железных гвоздей, вода дистиллированная, раствор хлорида натрия, раствор гидроксида натрия, медная и цинковая проволока. Ход работы: Поместить железный гвоздь в пробирку, наполнить ее доверху водой и опрокинуть в стакан с водой. Таким же образом заготовить другие пробирки с гвоздями, но в место чистой воды в пробирки и в сосуды, в которые они будут опрокинуты, налить раствор хлорида натрия. В одном случае к этому раствору добавить немного раствора гидроксида натрия. К одному гвоздю заранее прикрепить медную проволоку, к другому - полоску или проволоку цинка. Примерно через сутки наблюдать процесс коррозии железного гвоздя и цинковой полоски. Объяснить наблюдаемые явления. Сравнить результаты опытов. Написать уравнения реакций. Рис. 31. Электрохимическая коррозия железа. Утилизация. Все растворы из стаканов сливают в раковину, кроме раствора с соединениями цинка, который помещают в нейтрализатор. кальция Оборудование и реактивы: Спиртовка, спички, пробка со вставленной в нее спиралью от электроплитки, кристаллические хлорид калия, натрия, кальция, бария, раствор соляной кислоты (1:1). Ход работы: Спираль обрабатывают раствором соляной кислоты. Затем вносят спираль в пламя спиртовки и держат до полного выгорания примесей. Вносят спираль в кристаллическую соль, захватывают спиралью кристаллы соли и вносят в пламя спиртовки. Пламя окрашивается в различные цвета: катион калия дает фиолетовый цвет, катион натрия – желтый, катион кальция – красный, катион бария – зеленый. Использовать для каждого анализа чистую нихромовую спираль. Техника безопасности. Соблюдать правила работы со спиртовкой, выполнять действия в вытяжном шкафу. Опыт № 4. Устранение жесткости воды Оборудование и реактивы: Пробирки, спиртовка, спички, пробиркодержатель, вода дистиллированная, разбавленный раствор соды (5-10%), известковая вода, кристаллические хлориды кальция и магния, жесткая вода. Для приготовления воды с постоянной жесткостью необходимо в дистиллированной воде растворить хлориды кальция и магния или любые другие соли кальция и магния (примерно, 1% растворы). Воду с временной жесткостью готовят так: через свежеприготовленную и прозрачную известковую воду пропускают углекислый газ до полного растворения выпавшего осадка карбоната кальция. В растворе будет содержаться гидрокарбонат кальция. Этот раствор готовят непосредственно перед демонстрацией опытов. Ход работы: Устранение карбонатной (временной) жесткости: а) кипячение, катионы кальция осаждается в виде карбоната: Ca2+ + 2HCO3- F 0A E CaCO3 F 0 A F + h3O + CO2 F 0 A D. б) добавление известковой воды: Ca (HCO3)2 + Ca(OH)2 F 0A E 2CaCO3 F 0 A F + 2 h3O. Устранение некарбонатной жесткости. Добавить к жесткой воде раствор соды: CaCl2 + Na2CO3 F 0A E CaCO3 F 0 A F + 2 NaCl; MgSO4 + Na2CO3 F 0A E MgCO3 F 0 A F + Na2SO4. Рассмотреть другие способы устранения жесткости воды. Выразить процессы уравнениями реакций. Техника безопасности. При кипячении жесткой воды: а) сначала осторожно прогреть всю пробирку, б) затем прогреть всю воду, но не до кипения, в) довести до кипения верхнюю часть жидкости. Отверстие пробирки направить в сторону от себя и учеников. Все растворы слить в раковину, в них нет токсичных веществ. Опыт № 5. Механическая прочность оксидной пленки алюминия Оборудование и реактивы: Спиртовка, спички, стеклянная трубочка, штатив, алюминиевая проволока. Ход работы: В лапке штатива закрепляют алюминиевую проволоку, вставленную в стеклянную трубочку. Так как теплопроводность стекла небольшая, то все тепло будет “концентрироваться” на металле. Нагревают проволоку в пламени спиртовки. Алюминий плавится внутри оксидной пленки. Техника безопасности. Соблюдать правила работы со спиртовкой.
Полисахариды - крахмал и его свойства - Старт
Ключевые слова: крахмал, резистентный крахмал, колоректальный рак, пищевые волокна, амилоза, амилопектин, крахмальная кашица, реакция с йодом, физико-химические свойства крахмала, модификация, крахмал-декстринизация.
Фото: формула крахмала, http://www.szkolnictwo.pl/szukaj,Skrobia
Полисахариды представляют собой наиболее распространенные в природе органические соединения. Они представляют собой продукты поликонденсации моносахаридов, связанных между собой гликозидными связями.Суммарная формула моносахаридов может быть представлена в виде:
где:
М- означает любой моносахарид
n- количество моносахаридов
Молекулярная масса полисахаридов обычно колеблется от нескольких тысяч до нескольких миллионов.
По своей структуре полисахариды были разделены на две основные группы: гомогликаны, включающие монокомпонентные полисахариды, и гетерогликаны (т.е. многокомпонентные полисахариды) [2].
Крахмал в виде полисахарида
Крахмал представляет собой сахар, состоящий из двух полисахаридов, т.е.амилоза и амилопектин.
Амилоза образует простые цепи молекул глюкозы, соединенных между собой связями α-1α4.
Амилопектин имеет разветвленную структуру. Молекулы глюкозы в ее составе связаны α-1α6 связью, однако через каждые 25-30 глюкозильных остатков имеются α-1α6 связи, формирующие характерное для этой молекулы разветвление [2].
Оба полисахарида имеют разные физические свойства.
Водные растворы амилопектина характеризуются опалесцирующей окраской, а при взаимодействии с йодом проявляют фиолетовую окраску.В свою очередь, амилоза окрашивается йодом в синий цвет [2].
Крахмал классифицируется как пищевая клетчатка. Это полисахарид, расщепляемый пищеварительной системой на отдельные молекулы глюкозы. Существуют также так называемые резистентный крахмал, представляющий собой полимерную фракцию, не переваривающуюся в начальных отделах желудочно-кишечного тракта (это связано с высоким содержанием в молекулах амилозы). Устойчивый крахмал выдерживает переваривание в тонкой кишке и вместо этого попадает в толстую кишку, где оказывает положительное влияние на здоровье кишечника.Резистентный крахмал часто называют клетчаткой третьего типа (помимо растворимой и нерастворимой клетчатки). Этот вид крахмала содержится в бобовых, некоторых видах цельнозернового хлеба, в крупах, рисе и макаронах [4], [5], [1].
Крахмал играет очень важную роль в правильном функционировании толстого кишечника, поэтому он входит в состав пищевых волокон. Кроме того, крахмал способствует развитию полезной бактериальной флоры в толстом кишечнике, а его присутствие очень положительно влияет на правильное течение обмена веществ в организме.Эта особенность проявляется главным образом в синтезе холестерина и триглицеридов. Рекомендуемое суточное количество потребления резистентного крахмала составляет 20 граммов, что в четыре раза превышает среднесуточное количество крахмала. Поэтому ученым удалось создать традиционными методами сорт ячменя, содержащий повышенное количество резистентного крахмала, а также планировалось создать генетически модифицированный сорт пшеницы с аналогичными характеристиками [3].
Для достижения этих целей были использованы феномен молчания генов и генная инженерия.Таким образом, ученые отключили (заглушили) экспрессию гена SBEI у пшеницы, который участвует в синтезе крахмала (т.е. отвечает за образование амилопектина). В результате сайленсинга генов доля резистентного крахмала в пшенице увеличилась с 25% до 70%. Первые модифицированные растения были получены еще в 2005 году. В свою очередь, в 2009 г. ученые получили разрешение на первые полевые испытания генетически модифицированных сортов [3].
Согласно последним исследованиям, снижение количества резистентного крахмала в рационе вызывает заболеваемость колоректальным раком.Согласно проведенным исследованиям, самый высокий процент этого вида рака появляется у населения Австралии, где ежедневно регистрируется 30 новых случаев заболевания. И именно в Австралии колоректальный рак является вторым по распространенности раком. Ученые нашли причину столь частого возникновения этого заболевания и пришли к выводу, что за него ответственна диета с низким содержанием резистентного крахмала [4], [5].
Новые исследования показывают, что увеличение количества резистентного крахмала в рационе может быть одним из важных шагов в снижении заболеваемости раком толстой кишки.Весь цикл развития болезни занимает около 15 лет — от момента первого инициирования повреждения ДНК до развития полномасштабного колоректального рака, поэтому наши рационы следует улучшать раньше, вводя большее количество резистентного крахмала [4], [5]. В химическом отношении крахмал не является однородным материалом из-за того, что в его структуру входят молекулы амилозы и амилопектина.
Амилоза относится к линейным полимерам молекул -D-глюкозы, связанных между собой - (1-4') гликозидными связями, которые дополнительно закручены в спираль (спираль) - иногда даже в двойную спираль.Ненативный крахмал (подвергнутый некоторым процессам) может иметь неспиральную структуру. Схлопывание и разворачивание спирали — обратимый процесс — разветвленная амилоза встречается очень редко. Молекулярная масса амилозы составляет от 30 000 до 60 000 Да, т. е. амилоза состоит в среднем из 300—600 единиц глюкозы. Амилоза и амилопектин в крахмальном зерне обычно вкраплены и располагаются концентрически к центру зерна [6].
Фото: Крахмальные зерна, окрашенные раствором Люголя в ткани клубня картофеля, http: // www.bio-forum.pl/messages/3280/87084.html
В свою очередь амилопектин относится к разветвленным полимерам -D-глюкозы (со средней молекулярной массой 400000 Да) - состоящим в среднем из 2500 единиц глюкозы. Молекулы глюкозы связаны связями - (1-4') (прямой остов) и - (1-6') и - (1-3') (разветвления). Нативный амилопектин имеет разветвления, свернутые в короткие спирали из 2 или 3 витков.
Соотношение амилозы к амилопектину в крахмале колеблется от 1:3,5 до 1:5, однако существуют также крахмалы, содержащие до 98% амилопектина (примером может быть крахмал восковидной кукурузы) [6].
Приготовление крахмала
Для получения крахмала картофель необходимо промыть, а затем сделать пюре. К полученной кашице добавить равный объем воды, все это хорошо размешать, затем процедить раствор через несколько слоев марли. Полученный фильтрат разбавляют водой в 2-3 раза и оставляют декантироваться. После отстаивания декантируют надосадочную жидкость и суспендируют полученный крахмал в этаноле и фильтруют через воронку Бюхнера. Полученный крахмал после промывки этанолом высушивают на воздухе [2].
Проверка растворимости крахмала
а) К 1 г крахмала добавляют несколько мл воды, все хорошо перемешивают и затем фильтруют через фильтровальную бумагу. К полученному фильтрату добавить 1 каплю раствора йода KI. Жидкость не меняет цвет — остается бесцветной, что доказывает нерастворимость крахмала в холодной воде.
б) Приготовление крахмальной кашицы: вскипятить около 75 мл воды, затем во второй посуде приготовить однородную взвесь из 1 г крахмала в 15 мл холодной воды, которую вливают в кипящую воду при постоянном помешивании.Крахмальную посуду следует промыть 10 мл воды и добавить в кипящий раствор. Все кипятить до растворения. Таким образом получают однородный опалесцирующий раствор крахмала [2].
Реакция крахмала с йодом
При взаимодействии с йодом амилоза окрашивается в синий цвет, а амилопектин — в фиолетовый. Амилоза, имеющая линейную конфигурацию, не способна образовывать комплексы с йодом. Для этого должна быть спиралевидная конфигурация, чтобы молекулы йода могли в ней регулярно оседать.На каждые шесть глюкозильных остатков приходится одна молекула йода, т. е. на один спиральный виток. В результате нагревания спираль расцепляется, что приводит к исчезновению окраски йодом.
1)
К 2 мл крахмальной кашицы добавить каплю йод-йодистого раствора KI. Крахмальная кашица не должна быть щелочной. Появляется синяя окраска раствора.
Нагреть пробирку (с синей окраской раствора), в результате исчезновения синей окраски.С другой стороны, после охлаждения пробирки под проточной водой снова появляется синяя окраска [2].
2)
В пробирку вносят 1 см3 крахмальной кашицы, затем добавляют 1-2 капли раствора йода (наблюдают за окрашиванием)
Пробирку нагревают до кипения на водяной бане, охлаждают в струя холодной воды (наблюдайте за изменением цвета).
В пробирку добавьте каплю 1 М раствора NaOH, а затем каплю 1 М раствора HCl (наблюдайте за изменением окраски) [6].
Фото: Крахмальные зерна, окрашенные раствором Люголя в банановой ячейке, http: // www.bio-forum.pl/messages/3280/87084.html
Осаждение крахмала
Выполнение:
а) Внести в пробирку 1 см3 раствора крахмала. Добавьте 1 см3 насыщенного раствора сульфата аммония и наблюдайте за ходом реакции.
б) В пробирку налейте 1 см3 раствора крахмала. Добавьте 1 см3 этанола и наблюдайте за ходом реакции [6].
Химические свойства крахмала
Химически крахмал проявляет свойства альдегидов, спиртов и простых эфиров. Химические превращения крахмала приводят к получению так называемогомодифицированные крахмалы, или декстрины, и даже простые сахара (глюкоза, мальтоза). Так называемой Декстринизация представляет собой химическое, термическое или ферментативное расщепление цепей амилозы и/или амилопектина, в ходе которого происходит разрыв гликозидных связей, являющихся в некотором роде эфирными связями [6].
Изучение влияния оснований на окраску раствора йода
В щелочной среде окраска раствора крахмала не изменяется (окраска не образуется). После добавления к 2 мл крахмальной кашицы нескольких капель 1 М раствора основания NaOH и 1 капли раствора йода в KI появляется окраска раствора, а после подкисления раствором соляной кислоты появляется окраска [2].
Проверка свойств крахмала – до и после гидролиза
Для проверки свойств крахмала необходимо сначала провести тест Бенедикта с раствором крахмала. Для этого к 5 мл реактива Бенедикта добавляют 0,5 мл раствора крахмала, а затем помещают образец на кипящую водяную баню примерно на 5 минут. После инкубации окраска раствора не меняется, поэтому проба Бенедикта с крахмалом отрицательна [2].
Затем прокипятите раствор крахмала с соляной кислотой (HCl) или серной кислотой (h3SO4) в течение нескольких минут.После кипячения раствор следует охладить, нейтрализовать гидроксидом натрия (NaOH) и повторно провести тест Бенедикта (как указано выше). После приготовления этот тест положительный [2].
Гидролиз крахмала
Под действием кислот крахмал постепенно гидролизуется (через декстриновую стадию до мальтозы и небольшого количества глюкозы). Прямыми продуктами гидролиза крахмала являются:
- амилодекстрины (в результате реакции с йодом образуется фиолетовая окраска)
- эритродекстрины (красная)
- акро- и мальтодекстрины (не реагируют с йодом - не образуется окраска)
- мальтоза (нет реакции - окраски не возникает).
По мере гидролиза крахмала восстановительные свойства этого сахара постепенно возрастают [2].
Применение:
Приблизительно к 10 мл раствора крахмала добавить 1 мл концентрированной соляной кислоты (HCl) или серной кислоты (h3SO4) - конечная концентрация кислоты должна быть 1-2 М. Нагреть образец на кипящей водяной бане. . Далее расположите в стойке 2 ряда по 10 пробирок и каждую минуту переносите по несколько капель в пробирки первого и второго рядов [2].
В первом ряду пробирок по 1 мл очень разбавленного раствора йода (ок.0,002%), окраска растворов последовательно меняется от синей через пурпурную, красную, коричневую до бесцветной [2].
Нейтрализуйте вторую серию пробирок гидроксидом натрия, затем проведите тест Бенедикта (как описано выше). В результате протекающих реакций наблюдается все более выраженное восстановление по мере продолжения гидролиза [2].
Физико-химические свойства крахмала
На границе физико-химических свойств крахмала находится его способность к так называемому склеивание. Склеивание – это процесс, связанный с набуханием крахмальных зерен под действием воды, причем весь процесс происходит при повышенной температуре.Высокая температура разрывает меж- и внутримолекулярные водородные связи компонентов крахмала. В свою очередь, вода выщелачивает из крахмала амилозу, которая образует с ним коллоид. В крахмале разрушаются только водородные связи. Способность крахмала клейстеризоваться, а также вязкость получаемой кашицы и ее стабильность зависят от происхождения крахмала из растительного сырья [6].
Процесс желатинизации изменяет кристалличность крахмала. Рентген это так называемыйКрахмал типа V. На начальной стадии желатинизации крахмал становится более аморфным, затем молекулы амилозы организуются (путем агрегации в двойную спираль) за счет межмолекулярных водородных связей. Образовавшиеся агрегаты становятся нерастворимыми в воде и отделяются от растворов кашицы в виде дендритов — это так называемые ретроградация (необратимый процесс) [6].
Амилопектин не подвергается ретроградному процессу. Следствием ретроградации является сокращение межмолекулярных пространств, что затем вызывает вытеснение воды из ретроградной макроструктуры кашицы или геля, что, в свою очередь, приводит к обезвоживанию этого материала.Это явление, именуемое синерезисом, проявляется выделением воды на поверхность геля, подсыханием хлеба и т. д. Следует также отметить, что в узком диапазоне рН (ок. 11,2) кашица может агрегировать без образуя двойную спираль, то образуются только коллоидные мицеллы, обладающие способностью выпадать из раствора [6].
Модификации крахмала-декстринизация
Декстринизация (частичная деполимеризация) крахмала является одним из наиболее часто используемых способов его модификации. Декстринизацию проводят в воде при температуре выше 100°С, т.е. под давлением, кислотах (обычно разбавленной соляной кислотой), щелочах, кислых гидролизующих солях, термически, механически (высокое давление, измельчение, экструзия) и ферментативно.Однако обычно декстринизация представляет собой только гидролиз (также могут быть побочные реакции).
Все отмеченные в ходе процесса побочные реакции не являются незначительными, поскольку незначительные структурные изменения в продукте могут очень четко изменить вязкость их растворов – одно из важнейших технологических свойств продуктов [6].
Автор: Лидия Копервас
Литература:
[1]. Гавенцкий Я.,. Моссор-Петрашевска Т., коллективная работа, 2008. Сборник знаний о еде, питании и здоровье. Scientific Publishers PWN, стр. 221.
[2]. Клышейко-Стефанович Л., 2003. Упражнения по биохимии. Польское научное издательство PWN, 2003, стр. 280-282.
[3]. [http://gmo.blog.polityka.pl/2012/05/09/po-co-to-gieemo-pszenica-i-skrobia-odporna/]
[4]. Фицджеральд Р., 2012. Резистентный крахмал может помочь защитить от рака кишечника.http://csiro.au/en/Portals/Media/resistive-starch-may-offer-potential-to-help-protect-against-bowel-cancer.aspx
[5]. Морелл М., 2007. Новая пшеница со здоровым будущим. http://www.csiro.au/Outcomes/Food-and-Agriculture/New-wheat-with-a-healthy-future.aspx
[6]. [http://www.cbimo.zut.edu.pl/download/dydaktyka/chemia_bezpiecznosci_tz_iii/cwiczenia_laboratoryjne/%20%20%20%20%20Skrobia,%20%C4%87w.%209.pdf]
химических реакций, вызывающих изменение цвета 💫 Научно-популярный мультимедийный портал. 2022
Химическая реакция не всегда видна человеческому глазу, но иногда она вызывает впечатляющее изменение цвета и делает научные эксперименты более приятными. Когда два или более вещества объединяются, они образуют одно или несколько новых веществ, из которых иногда имеют молекулярную структуру, отличную от исходных веществ, то есть они поглощают и излучают свет по-разному, что приводит к изменению цвета.
Гидроксид натрия и фенолфталеин
Фенолфталеин является универсальным индикатором, то есть он меняет цвет, чтобы показать рН некоторых растворов. Фенолфталеин остается бесцветным в кислых растворах и розовеет в щелочных растворах. Гидроксид натрия является основанием, поэтому при добавлении фенолфталеина раствор становится розовым. Другими индикаторами, обычно используемыми в лаборатории, являются лакмус и метиловый оранжевый. Раствор индикатора Лакмус становится красным в кислых растворах, синим в щелочных и фиолетовым в нейтральных.Метилоранж становится красным в кислых растворах и желтым в нейтральных или щелочных растворах.
Растворы крахмала и йода
Тест на крахмал представляет собой химическую реакцию, которая определяет, присутствует ли в веществе амилоза крахмала. Когда крахмал добавляется к йоду в воде, он образует комплекс крахмал/йод с интенсивным синим цветом. Чтобы проверить, присутствует ли в пище крахмал, смешайте раствор йода и йодида калия в воде. Раствор светло-оранжево-коричневого цвета, но становится сине-черным при нанесении непосредственно на образец, содержащий крахмал (например, картофель или хлеб).
Гидратированный карбонат меди
Когда медь вступает в реакцию с элементами (кислородом, водой и углекислым газом), она меняет цвет с красновато-коричневого на зеленый. Эта химическая реакция представляет собой гидратированный карбонат меди, известным примером которого является Статуя Свободы. Построенная в 1886 году, Статуя Свободы изначально была красновато-коричневой. Со временем медные пластины подверглись химической реакции. То же самое может случиться и с медными монетами. Аналогичная реакция происходит, когда железо ржавеет: на его поверхности образуется оксид железа (окисление), в результате чего железо становится красноватым.
Демонстрационная синяя бутылка
«Демонстрационная синяя бутылка» включает раствор глюкозы, гидроксида натрия, метиленового синего и дистиллированную воду. После встряхивания раствора в частично наполненной бутыли в раствор поступает кислород, окисляющий метиленовый синий и окрашивающий раствор в синий цвет. Когда удар прекращается, кислород выходит из раствора и снова становится бесцветным. Это обратимая окислительно-восстановительная реакция.
Иногда изменение цвета представляет собой просто смешение двух цветов, а не изменение состава используемых веществ.Например, добавление красного пищевого красителя и синего пищевого красителя в стакан с водой дает пурпурную воду, но никакой химической реакции не происходит. Вещества растворялись внутри себя, но сохраняли свою молекулярную идентичность.
.Биология - Экзамен на аттестат зрелости май 2016, уровень Advanced (Формула 2015) - Задание 14. 9000 1
Две группы студентов подготовили одинаковые экспериментальные наборы для проверки от чего зависит активность фермента, расщепляющего крахмал в слюне. Через пять В пробирки учащиеся помещали по 1 мл водного раствора с определенным рН (4-8). Затем в каждую пробирку добавляли по 1 мл разведенной кашицы, приготовленной из крахмала. картофеля с небольшим количеством соли (NaCl).Первая группа разместилась пробирки на водяной бане при температуре 30°С, а другую - на бане при температуре 37°С. В каждую пробирку студенты добавляли по 1 мл свежей слюны и перемешивали содержимое. а затем, с интервалом в одну минуту, отбирали смесь из каждой пробирки. одну каплю раствора за раз и проверяли, весь ли крахмал распался. Результаты, которые они собрали в таблице.
| рН раствора | Время разложения крахмала [мин] | |
|---|---|---|
| температура 30°С | температура 37°С | |
| 4 | 18 | 14 |
| 5 | 14 | 9 |
| 6 | 8 | 4 |
| 7 | 6 | 3 |
| 8 | 7 | 4 |
14.1. (0-1)
Назовите фермент слюны, расщепляющий крахмал.
14.2. (0-1)
По результатам эксперимента сформулируйте вывод об оптимальной активности испытуемого фермента.
14.3. (0-1)
Укажите, как учащиеся могут проверить во время эксперимента, что весь крахмал уже расщеплен. Учитывайте название используемого реагента и его действие.
Решение
14.1. (0-1)
Схема выставления баллов
1 балл - за правильное указание названия фермента.
0 б.- за любой другой ответ или за отсутствие ответа.
Раствор
Амилаза (слюнная)
Примечание:
Для указания названия фермента требуется правильная биологическая терминология. 90 109
14.2. (0-1)
Таблица подсчета очков
1 стр.- за составление корректного заявления по результатам проведенного опыт, связанный с обоими факторами (температура и рН) или к условиям в ротовой полости.
0 р.- за ответ, не соответствующий вышеуказанным требованиям, или за отсутствие ответа.
Образцы растворов
- Оптимальным рН для действия испытуемой амилазы слюны является нейтральный рН и температура 37°С.
- Тестируемая амилаза имеет оптимум действия при рН 7 при 37°С.
- Амилаза слюны имеет оптимум действия в условиях, сходных с условиями в полости рта человека. 90 135
- Добавьте реагент к каждой взятой пробе, например, каплю раствора Люголя, и затем наблюдайте за изменением цвета раствора. Если появляется синий/темно-синий цвет, крахмал в образце еще не переварен.
- Впечатляет - легко возгоняется, выделяя фиолетовые пары
- Это микроэлемент, необходимый для правильного функционирования щитовидной железы.
- Плохо растворим в воде, но при добавлении йодистого калия растворимость его увеличивается - образуется раствор Люголя.
- Его много в водорослях, морской рыбе и йодированной соли.
- Первый образец подвергается воздействию солнечного света в течение двенадцати часов в открытом сосуде. Второй, тоже в открытом сосуде, хранить в темноте (не в холодильнике). Затем проводим титрование.
- Прокипятите образец в течение 15-20 минут (можно добавить выпаренную воду), а после охлаждения титруйте.
- Первый образец подкисляют, добавляя чайную ложку уксуса (10% раствор уксусной кислоты) или щепотку лимонной кислоты (также продается в продуктовых магазинах).Ко второму образцу налейте чайную ложку бикарбоната натрия NaHCO 3 (продается в продуктовых магазинах как пищевая сода) или небольшое количество раствора NaOH. Мы оставляем образцы в темноте в открытых контейнерах и титруем через двенадцать часов.
- В первый образец вставлен кусок медной проволоки, во второй - алюминиевый, в третий - железный гвоздь. Оставить сосуды открытыми без доступа света и через двенадцать часов оттитровать их содержимое ( 3 ).
- Аскорбиновая кислота хорошо растворяется в воде. Поэтому избегайте длительного хранения овощей в воде (например, картофеля или цветной капусты).
- Витамин С чувствителен к действию света и кислорода, содержащегося в воздухе (особенно оба эти фактора вместе оказывают крайне разрушительное действие). Заявление? Готовые блюда храним в закрытой посуде и не выставляем на свет (лучше в холодильнике).
- Приготовление пищи также в значительной степени разрушает аскорбиновую кислоту. Поэтому вам следует есть как можно больше овощей и фруктов в сыром виде, а когда вам нужно их разогреть – быстро сварить в небольшом количестве воды (еще лучше на пару).
- Витамин С разлагается намного быстрее в щелочном (и нейтральном) растворе. Пищу следует подкислять, например, лимонным соком, уксусом или лимонной кислотой.
- Контакт с металлами разрушает витамин С.Поэтому избегайте хранения продуктов с высоким содержанием аскорбиновой кислоты в металлической посуде. Для натирания овощей и фруктов используйте пластиковые терки вместо металлических.
14.3. (0-1)
Схема балльной оценки
1 балл - за правильное описание использования реактива для определения наличия крахмала, исходя из названия реагента и наблюдаемого эффекта, т. е. специфического изменения цвета, чтобы прочитать результаты эксперимента.
0 р.- за ответ, не соответствующий вышеуказанным требованиям, или за отсутствие ответа.
Образец раствора
Примечание:
Допустимые названия реагентов : Йод / I 2 KI.
Не считается названным в ответе реагентом: йодоформ, йод.90 109
Йод и его свойства |
Что привело вас на этот сайт? Наверное йод - такой химический элемент . Если в этом районе недавно произошла ядерная катастрофа, и вы не собираетесь самостоятельно производить раствор Люголя, то вы, вероятно, просто ищете материал по йоду, верно?
Вы попали по адресу, особенно если у вас достаточно знаний, подаваемых в типичном реферате, школьном или энциклопедическом виде. Я сам страдал, когда мне приходилось читать такие сверхмощные материалы при сборе данных для этого поста - так что я понимаю, что ваш мозг нуждается в изменении!
Отсюда идея серии "Химические истории для подушки".Не относитесь к этому исследованию слишком серьезно. Это для того, чтобы помочь вам вспомнить действительно самые важные факты (в запоминании скорее не годится для переписывания в качестве домашнего задания).
Пусть это будет легким чтением, что поможет вам выучить химию . Если вы хотите использовать его, чтобы оживить свою лекцию или урок химии - вперед. Химия может быть терпимой!
Йод впечатляет!
Супер краткое введение: Йод можно найти в периодической таблице под символами и .Это галоген, неметалл, который в твердом состоянии выглядит так:
. источник фото: (автор Dnn87 — собственная работа, CC BY 3.0, https://commons.wikimedia.org/w/index.php?curid=3367261) Кристаллическая структура йода (автор Бен Миллс — собственная работа, общественное достояние, https: //commons.wikimedia.org/w/index.php?curid=4200930)Matias Molnar - Laboratorio Quimica Inorganica II - UBA, Argentina, CC BY-SA 3.0Как видите, это обычные сине-черные кристаллы с легкий блеск. Где тут шоу? Достаточно его немного нагреть и начинается "фейерверк" - йод начинает бешено испаряться при фиолетовом цвете (фото плохого качества, к сожалению).Это объясняет, откуда взялась идея названия этого элемента (от латинского íon «фиолетовый» или ioeidḗs «фиолетовый»).
Если вы учитель химии и хотите познакомить учащихся с явлением сублимации , йод отлично подойдет для этого. Впечатляющий ВАУ-эффект! Легко запомнить - выпаривание твердого тела, т.е. процесс сублимации (мудро говоря, переход из твердого состояния в газообразное без жидкой фазы).
Иод-испаритель также может быть вам полезен, если вы являетесь специалистом TLC (имеется в виду, что вы маркируете вещества или отдельные смеси химических веществ с помощью тонкослойной хроматографии ).Фиолетовые пары используются для проявления пластин, используемых в этом аналитическом методе.
Йод в виде жидкости Люголя или йода также используется для обнаружения крахмала . Он окрашивает его в темно-синий цвет.
Йод необходим нашему организму.
Йод необходим для производства тироксина (Т4) и трийодтиронина (Т3), гормонов щитовидной железы регулирующих работу всех клеток организма. Так что очень нужно!
Думаете о добавках йода? Отлично, но вам должно быть достаточно употребления йодированной поваренной соли.
Чистый йод токсичен . Его лучше не есть - будет рвота темного цвета, боли в животе, пятна во рту, шум в ушах. При прямом попадании на кожу он вызывает сильное раздражение, раны и некроз — ничего страшного.
В любом случае, даже если бы йод был съедобным, 200-граммовая упаковка не нужна. Средняя суточная потребность в йоде составляет 200 мкг. Это означает, что человеку, который проживет 80 лет, в течение всей жизни потребуется всего 5,844 г йода.Таким образом, такой упаковки хватило бы на жизненные потребности 34 человек. И было бы еще немного!
Так что запомните хорошенько: йод токсичен. Не берите его кристаллы. Достаточно съедать в день филе средней трески, слабосоленое йодированной солью (содержание йода в йодированной соли 2293 мкг/100 г, в треске 110 мкг/100 г).
Хотите приготовить жидкость Люголя?
Раствор Люголя— это, проще говоря, водный раствор йода (сейчас вы узнаете, почему, упрощенно).Дело в том, что после взрыва Чернобыльской АЭС все молодые люди до 17 лет пили жидкость Люголя. Вы когда-нибудь задумывались о накоплении запасов на случай ядерной катастрофы? Это не лучшая идея – применение раствора Люголя должно быть под пристальным наблюдением врача .
Помните, что такое правильная суточная доза йода? Вы можете легко справиться с этим, выпив этот препарат, что приведет к и тяжелому гипертиреозу. Так что, если вы не собираетесь делать тиреоидэктомию (тиреоидэктомию), раствор Люголя вам не понадобится.
Хорошо, вас предупредили, и вы все еще хотите приготовить этот водный раствор йода? Вообще смысла нет, проще было бы просто купить в аптеке. Так или иначе, все необходимые ингредиенты для его приготовления можно найти в нашем магазине:
Добавьте йодид калия в 4 г дистиллированной воды. В этом растворе растворить йод и довести водой до 100 г. Поздравляю, вы сделали раствор Люголя и стали химиком 🙂
Почему в растворе Люголя содержится йодид калия (KI)?
К чему это упрощение? Как видите, в список ингредиентов помимо йода и дистиллированной воды входит еще и йодистый калий.Следовательно, на самом деле раствор Люголя является раствором йода в растворе йодида калия.
Йод хорошо растворяется в спиртах или органических растворителях (хлороформ, ацетон и др.), но очень плохо в воде. В чем причина?
Можно посмотреть на это с этой стороны: Для образования раствора растворитель и растворенное вещество должны быть похожи друг на друга . Сколько? Достаточно того, что их невозможно различить, когда они смешиваются друг с другом.Кроме того, разделить их не так просто.
Как это выглядит с молекулой йода и молекулой воды? Размер молекулы йода составляет 494 мкм, а молекулы воды — 275 мкм. У них тоже совсем другой характер - йод неполярный, а вода. Они не имеют никакого отношения друг к другу, поэтому ни о каких удачных «отношениях» не может быть и речи.
Поэтому необходимо добавление йодида калия, который действует как солюбилизатор (среда растворения). Происходит явление гидротопической солюбилизации , после чего ионы -йодида соединяются с молекулами йода с образованием трийодид-иона.Он имеет отрицательный заряд, что делает его полярным — поэтому он начинает «нравиться» воде и хорошо в ней растворяется, согласно следующему уравнению:
I 90 107 2 90 108 + I 90 109 - 90 110 → I 90 107 3 90 108 90 109 - 90 110
Напоследок загадка: Что есть у йода для Йоды?
Все поклонники саги «Звездные войны» знают невысокого зеленого мастера йедай — Йоду. Так какое отношение йод имеет к йоде?
Может быть, вы скажете: «Какой абсурдный вопрос». А вы знаете, как лучше всего учиться? Создавайте ассоциации, яркие образы, возникающие в сознании за доли секунды.И есть даже две связи между йодом и йодой.
Во-первых, цвет зеленый. В прошлом йод получали из зеленых водорослей 🙂 Из 2000 кг водорослей можно получить 1 кг этого элемента.
Второй - старость. В настоящее время лучшим источником йода является рапы из нефтяных скважин. Сырая нефть - очень старое вещество (еще старше хозяина Йоды) - оно образовалось в результате разложения морских организмов, накапливавших йод на протяжении всей своей жизни.Потом они погибли, упали на дно океанов и превратились в коричневую густую жидкость — сырую нефть.
Видишь? Благодаря Мастеру Йоде вы уже знаете, где добывают йод!
Несколько причин, по которым вас может заинтересовать йод
А теперь все сообщения в двух словах (или лучше: в маленькой конфетке , потому что пилюли могут быть горькими, а наша миссия - сделать химические знания опасными).
Теперь вы знаете о йоде все, что нужно для начала. Поздравляем!
Или, может быть, вы хотите узнать больше о другом галогене - хлоре? Обязательно прочтите: Почему хлор должен представлять интерес для химика (и не только)? Чтобы перейти к посту, нажмите на заголовок или изображение ниже.
Каталожные номера:
Содержание йода в пищевых продуктах
Диаметр частиц йода
В предыдущей статье этой серии мы доказали восстановительные свойства аскорбиновой кислоты. Последний выпуск посвящен факторам, губительно влияющим на содержание этого соединения в пищевых продуктах. Их знание позволит вам избежать потерь витамина С при приготовлении и хранении пищи.
Проведем еще один опыт, показывающий, что аскорбиновая кислота является восстановителем (окажется тесно связанным с предметом данной статьи).
Йодометрия
1. Йодометрическое определение содержания витамина С. Добавляйте раствор йода по каплям (слева) до тех пор, пока окраска содержимого стакана не станет постоянной (справа).
Вам понадобится раствор йода (например, йод - дезинфицирующее средство в виде 3% раствора йода в этаноле с 1% йодидом калия) и индикатор крахмала, окрашивающийся в интенсивный синий цвет при наличии свободного йода. Приготовьте последний, растолочь половину чайной ложки картофельной муки с примерно дюжиной см 3 холодной воды.Полученную кашицу переложить в 100-200 см 3 кипящей воды и кипятить несколько минут, постоянно помешивая. После остывания хранить раствор в плотно закрытой посуде в холодильнике.
Поскольку свободный йод оставляет коричневые пятна на коже, одежде или столешницах, необходимо соблюдать осторожность при обращении с раствором йода. Поэтому необходимо защищать кожу рук (например, с помощью пластиковых перчаток, прикрепленных к краскам для волос) и окружающую среду (испытания проводятся на лотке).Сами пятна удаляйте раствором тиосульфата натрия Na 2 S 2 O 3 или витамином С.
Пришло время для эксперимента. Налейте в пробирку 1 см 3 раствора аскорбиновой кислоты, разбавьте его несколькими см 3 воды и добавьте 1 см 3 индикатора крахмала. Теперь по каплям добавляйте йод, перемешивая при этом содержимое сосуда. Падающие капли йода вначале сразу же обесцвечиваются. Однако мы можем распознать приближение конца теста по все более и более продолжительному времени обесцвечивания раствора.Когда следующая капля вызывает стойкое окрашивание содержимого пробирки, витамин С полностью окисляется (1).
Текущая реакция записывается уравнением (формулы в сводной форме):
Дальнейшие действия будут зависеть от имеющегося в вашем распоряжении лабораторного оборудования. Попытаемся количественно определить содержание аскорбиновой кислоты в пробах, чтобы найти влияние различных факторов на разрушение витамина С. Определения проведем методом титрования, используя раствор йода известной концентрации.Когда у нас есть настоящий набор для титрования, состоящий из бюретки, мерной колбы и пипетки (или у нас есть доступ к нему, например, на уроке химии в школе), наши результаты должны быть очень точными ( 2 ). сама пипетка также даст результаты. Если этого у нас нет, остается простой метод подсчета капель использованного раствора йода (используем обычную капельницу). Тем не менее, мы должны знать, что ключевым фактором точности определения является поддержание одинакового размера капель (хотя результаты, вероятно, в любом случае будут весьма подвержены ошибкам).
2. Набор для титрования - бюретка на штативе, коническая колба с титровальным раствором и мерная колба.
Начинаем титрование с определения т.н. титр раствора йода, т.е. просто его концентрация в имеющемся у вас растворе. В нашем случае это будет количество витамина С (в мг), которое вступает в реакцию с данным объемом раствора. Готовим раствор аскорбиновой кислоты. Таблетку с содержанием 100 мг тщательно измельчают и растворяют в 100 см 3 воды (точно отмерено).Таким образом, мы имеем раствор, который в 1 см 3 содержит 1 мг витамина С. Берем пробу объемом 5 см 3 (тоже точно отмерено), разбавляем ее в колбе с дюжиной см 3 воды и добавьте половину чайной ложки индикатора крахмала. Имеющийся раствор йода разбавляют 1:1 этанолом (например, обесцвеченным денатуратом). Наполните им бюретку или пипетку и медленно прикапайте раствор йода в колбу (все время помешивая ее содержимое). Стойкая синяя окраска означает полное титрование витамина С.Считываем объем использованного раствора йода и вычисляем, сколько см 3 соответствует содержанию 1 мг аскорбиновой кислоты в растворе. При использовании только капельницы мы знаем, сколько капель эквивалентно 1 мг витамина С. Для точности повторите титрование и используйте в качестве результата средний объем используемого раствора. Теперь вы можете определить наличие витамина С во фруктовых соках и проверить его содержание, указанное производителем.
Что разрушает витамин С?
В прошлом месяце мы узнали, что аскорбиновая кислота легко реагирует с окислителями.Существует множество факторов, ускоряющих деградацию витамина С, что приводит к снижению его содержания в пищевых продуктах.
3. Исследование влияния контакта с металлом на разложение витамина С (в банках слева направо: железо, медь, алюминий).
Для испытаний готовят растворы аскорбиновой кислоты известной массы этого соединения (как и при титровании раствором йода). После завершения эксперимента мы титруем образцы и подсчитываем, насколько уменьшился витамин С.
Полученные результаты могут значительно различаться в зависимости от имеющегося у вас раствора йода, размера используемого образца и условий эксперимента. Однако в каждом случае мы обнаруживаем разрушающее действие тестируемых факторов (свет, кислород, повышенная температура, щелочной раствор, контакт с металлами) на содержание витамина С.
Как минимизировать потери?
Потеря витамина С неизбежна при приготовлении и хранении пищи.Тем не менее, вы можете использовать выводы из проведенных экспериментов, чтобы уменьшить его потери.
Приведенные рекомендации не требуют революционных изменений в технологии кухни и могут способствовать повышению пищевой ценности приготовляемых блюд. Ради собственного здоровья и здоровья домочадцев стоит их выполнять.
"Реакция аптечных часов"
В заключение (для настойчивых читателей, дочитавших статью до этого места) еще один эксперимент с витамином С.
К уже имеющимся реактивам достаточно добавить перекись водорода (3% раствор H 2 O 2 , препарат доступен в аптеках и аптечных магазинах в качестве дезинфицирующего средства) ( 4 ). реакция аптечных часов» (она была представлена в химическом отделе «Młedego Technika» в выпуске 2/2014), но ее необычный ход делает опыт всегда стоящим.
4. Для проведения «реакции аптечных часов» необходимы йод, витамин С и перекись водорода.
Налейте примерно 50 см 3 раствора витамина С (содержащего примерно 50 мг аскорбиновой кислоты) в химический стакан или колбу и добавьте 1-2 см 3 йода. Затем всыпать пол чайной ложки индикатора крахмала и 10-15 см 3 перекиси водорода. Через десяток секунд содержимое сосуда быстро окрашивается в темный цвет ( 5 ).
5. Добавьте раствор витамина С (слева) к раствору йода, затем добавьте по каплям раствор крахмала (в центре) и перекись водорода.Примерно через десяток секунд содержимое сосуда быстро меняет цвет (справа).
«Реакция аптечных часов» — разновидность реакции часов Харкорта. При добавлении в раствор йода он реагирует с аскорбиновой кислотой:
Образовавшиеся анионы йодида окисляются перекисью водорода до свободного йода:
Выделившийся йод снова восстанавливают витамином С. Только когда все количество аскорбиновой кислоты истощается, свободный йод вступает в реакцию с крахмалом, окрашивая содержимое стакана.Изменяя количество реагентов, мы можем регулировать время конечного эффекта (например, увеличение количества витамина С продлит время ожидания).
Витамин С для левшей?
Это один из новых медицинских мифов. Он обвиняет фармацевтическую промышленность в продаже в аптеках бесполезных препаратов витамина С. Эффективными должны быть только те, которые доступны в интернет-магазинах (разумеется, по достаточно высокой цене). Предполагаемая причина в том, что промышленные продукты должны содержать витамин С или смесь его разновидностей.К чему вся эта суета?
Существуют химические соединения с одинаковым составом и структурной формулой, но все же отличающиеся друг от друга. Различия проявляются в тонкой форме — изомеры закручивают плоскость поляризованного света в противоположную сторону (оптическая изомерия). Многие биомолекулы проявляют этот тип изомерии, и живые организмы обычно производят только один вариант соединения (другой биологически неактивен или даже токсичен). То же самое и с витамином С.Его полное название L-(+)-аскорбиновая кислота. Знак «плюс» указывает направление вращения — вправо (знак «минус» имеет отношение, которое поворачивает влево). С другой стороны, буква L означает только фиксированную конфигурацию по отношению к некоторому примерному соединению (выделенная группа в молекуле направлена в написанной формуле влево - буква D означала бы группу, направленную вправо). Буквенное обозначение не имеет ничего общего с фактическим направлением вращения (и конфигурации L, и D могут быть по часовой стрелке) ( 6 ).
Полная формула витамина С показывает, что это правостороннее соединение. Конечно, есть левовращающий изомер витамина, но он не обладает его физиологическими свойствами. Левосторонний витамин С, к сожалению, еще один пример использования человеческого невежества. .- NATURAL LABORATORY
Цель эксперимента: Проверка силы поверхностного натяжения.
Перед проведением эксперимента мы попытались предсказать, сколько капель воды можно нанести на монету достоинством в один пенни, чтобы с нее не стекала вода.
Следующие шаги:
Капнули капелькой воды на монетку и проверили предсказания :)
Результаты наблюдения: мы наносили пипеткой на монету последовательные капли, наблюдали, что капли сливаются друг с другом, т. е. на молекулы воды, соединяющие капли, должны действовать какие-то силы.Размер капли «растет». Со следующей каплей - капля воды растворяется. Результаты были смешанными. Рекордсмены смогли поставить более 30 капель! :)
Объяснение наблюдаемого явления: на последовательные капли действуют силы, притягивающие большее количество молекул воды – эти силы являются силами сцепления (силами, действующими между молекулами одного типа). На большей капле образовалась тонкая пленка — это поверхностное натяжение. При следующем падении «пленка» разрывалась и капля выплескивалась.:)
Обнаружение витамина С в пищевых продуктах
Витамин С укрепляет наш иммунитет, ускоряет заживление ран, участвует в развитии костной ткани, обладает бактерицидными свойствами. На своем опыте мы проверили, в каких продуктах он есть и где его больше всего.
Для опыта нам потребовались:
группа I - таблетка витамина С, растворенная в 20 мл воды, йод, сок лимона, сок квашеной капусты, сок яблочный, кашица крахмальная;
группа II - таблетка витамина С, растворенная в 20 мл воды, йод, мандариновый сок, морс, картофельный сок.
В каждую из 8 баночек крахмальной кашицы мы добавили по 2 капли йода. Цвет жидкости изменился на темно-синий. Затем пипеткой добавляли испытуемые вещества в крахмально-йодный раствор. Контрольным набором служил раствор крахмала с йодом с добавлением измельченного
и растворенного в воде витамина С. Считали, через сколько капель жидкость стала прозрачной. Вносим результаты в таблицу. Чем меньше капель пришлось использовать - тем больше витамина С было в данном продукте.
Выводы:
Каждый из протестированных пищевых продуктов содержит витамин С.
Больше всего витамина С в лимонном соке и мандариновом соке, а меньше всего в
картофельном соке и фруктовом соке из пакета.
Визуализация силовых линий магнитного поля
Необходимые материалы:
- различные магниты: брусок, подкова, неодим
- железные опилки
- лист бумаги
Описание метода:
Положите на стол магнит и накройте его листом бумаги.На лист насыпаем небольшое количество опилок, чтобы лист создавал впечатление обсыпанного. Слегка постукиваем по краю страницы. Наблюдаем за расположением документов. Повторим опыт для разных магнитов.
Новая алхимия: кое-что о йоде
Запись изначально задумывалась как снимок того, что тоже произошло со мной когда-то в лаборатории, стала для меня несколько шире, так что речь пойдет в основном о йоде и его аналитике.
Для обнаружения йодидов в исследуемом растворе классическим качественным анализом в "пробирке" обычно к нему добавляют хлорную воду и встряхивают с хлороформом. Хлороформ не смешивается с водой и оседает на дно в виде отдельного слоя, розовеющего при встряхивании с йодсодержащим раствором:

В данном случае раствор был достаточно концентрированным, поэтому цвет очень отчетливый.Вы также можете увидеть разницу между цветом водного и органического раствора йода. В воде, в которой плохо растворяется, дает бурую окраску с оранжевым оттенком. Откуда эта разница?

Чтобы объяснить такое поведение, нужно начать с причины фиолетового цвета элемента, видимого в газообразном состоянии. В твердом состоянии более крупные комки напоминают голубоватый графит, только в мелких, полупрозрачных зернах или просто парах можно увидеть интенсивный фиолетовый цвет.
Йод образует двухатомные молекулы с ковалентной связью между ними.Этот тип связи заключается в соединении одного свободного электрона из соединяющихся элементов в пару и размещении его в пространстве между атомами. Эта « связывающая электронная пара » взаимодействует в комплексе с обоими атомами, поэтому она «общая» для них, и каждый получает впечатление октета — наиболее прочной конфигурации электронов в окружающей среде. Однако если мы описываем вещи методами квантовой механики, которая рассматривает электроны как нечеткие облака, а не как сферы на своих орбитах, все становится немного более запутанным.
В квантовой модели атома вместо стреляющих шаров мы имеем, как я уже сказал, облако — фактически орбитальное. Мы знаем, что электрон находится в этом пространстве, но с разной вероятностью, что фактически выливается в разное распределение его заряда. Связь между атомами йода образована внешними сигма-электронами, орбитали которых имеют сферическую форму, а их перекрытие создает общую молекулярную орбиталь, покрывающую всю молекулу примерно в форме мяча для регби:

Однако существует гораздо больше способов соединения орбиталей, и каждый из них имеет немного другую энергию.В этом случае высшая реальная сигма-орбиталь ( HOMO ) сопровождается низшей потенциальной орбиталью над ней ( LUMO ), которая не является полной. Энергетические уровни этих орбиталей настолько близки, что состояние электрона может меняться от одной возможности к другой, нужно только снабдить его определенным количеством энергии. Например, он может поглотить квант света, соответствующий определенному цвету.
Если вы отрежете один из белых лучей, представляющих собой смесь всех цветов, сумма остальных цветов будет выглядеть как противоположный цвет.При этом интенсивное поглощение зеленого вызывает образование фиолетовой окраски свободных пар этого элемента. Несколько иначе обстоит дело с решениями.
Я уже писал здесь, что в школьной дидактике при описании растворения этот процесс представлен так, как если бы он происходил в вакууме, потому что на самом деле растворитель всегда в той или иной мере взаимодействует с молекулами растворяемых веществ. Часто молекула окружена слоем сильно притягивающихся частиц растворителя, что влияет на ее свойства.
В случае с йодом полярные растворители обладают достаточной силой для образования комплекса, передавая часть заряда йоду. Энергетические уровни реальной и потенциальной молекулярных орбиталей раздвигаются, йод начинает поглощать другую длину волны и меняет цвет на коричнево-красный. Поэтому в воде и ацетоне образует растворы такого цвета. В менее взаимодействующих растворителях, таких как дихлорметан, он имеет ярко-красный цвет. В еще более слабых, таких как хлороформ или бензол, он розовый, а в самых слабых, таких как гексан, образует фиолетовый раствор, как и на воздухе.Это один из ярчайших примеров сольватохромизма.
 |
| B Крахмал йодированный |
Крахмал , как я недавно объяснял, представляет собой природный полимер, состоящий из молекул глюкозы, связанных в длинные цепи.В зависимости от типа цепи различают простую амилозу и разветвленный амилопектин — в случае последнего взаимодействия они заставляют эти цепи скручиваться в пружины.
Йод очень плохо растворяется в воде, если только в ней не присутствуют йодид-ионы — тогда он соединяется в трииодид-ионы, представляющие собой удлиненные молекулы. Такой раствор называется раствором Люголя (в то время как классический йод — это раствор в спирте). Так уж получилось, что размер амилозной «пружины» соответствует размеру молекулы трийодида, поэтому она помещается между скрученными витками, образуя довольно прочный комплекс интенсивного темно-синего цвета.

Цвет комплекса в некоторой степени зависит от концентрации йода — у очень мелких он темно-синий, у более крупных — от бурого до красного. Окраска заметна уже при количестве 0,00002 моль/л йода в растворе. Этим же методом можно обнаружить йодиды — хотя сами они не реагируют с крахмалом, но могут быть превращены в йод путем окисления. Если к испытуемому раствору добавить крахмальную взвесь и, например, хлорную воду, то часть йодидов окислится и образующийся комплекс это проявит.
Нетрудно догадаться, что раз мы можем обнаружить йод по крахмалам, то мы можем обнаружить и крахмал с йодом – и действительно, йодный тест используется для проверки количества и распада крахмала в растениях и продуктах питания. Так можно проверить, например, степень спелости яблок - молодые плоды содержат в основном крахмал и фруктовые кислоты, от которых и исходит терпкий вкус молодых яблок; по мере роста крахмал расходуется и на его месте появляется все больше и больше сахаров, маскирующих кисловатый привкус. После разрезания плода поверхность поливают жидкостью Люголя – в зависимости от размера и распределения окраски плодам присваивают разную спелость.Таким способом также можно обнаружить наличие крахмала (в том числе его химически модифицированных производных, о которых я писал) там, где его быть не должно — например, в молочных продуктах, для которых производитель не заявляет добавки. Стобинский прекрасно описал это в «Хемии и жизни».
Но и это еще не все — мы знаем, что для реакции необходимы, например, йодиды, крахмал и окислители, поэтому, имея первые два, мы можем обнаружить третий компонент.
Это могут быть сильные окисляющие газы, такие как хлор и бром, или озон.Йодокрахмальная бумага, содержащая йодиды и крахмал, темнеет после намокания и нанесения на выходное отверстие пробирки, из которой, как мы полагаем, выходят эти газы. Профессиональные тест-полоски часто имеют шкалу, по которой в той или иной степени можно определить концентрацию оксидантов – так, например, проверяется, не превышает ли нормы количество хлора в питьевой воде и воде для купания.
Это могут быть сильные окислители в растворе, например хлораты или перекись водорода, но и здесь, в больших количествах, окраска может проявиться ненадолго - выделившийся йод дополнительно окисляется до бесцветных йодатов.Они могут быть еще более слабыми окислителями, если их соответствующим образом прореагировать - например, нитриты (нитраты III), в отличие от нитратов V. Некоторые металлы также реагируют с образованием йода - например катионы меди II и железа III, которые являются довольно слабыми окислителями. - так что мы, вероятно, могли бы использовать бумагу для обнаружения этих металлов, но мы знаем другие тесты для них. Эти три, относящиеся к аналитическим возможностям, представлены на графике:

Итак, мы уже знаем, как обнаруживать йод и что он может обнаруживать, но есть еще одно аналитическое применение йода — количественное определение йодометрическим титрованием.
Вся идея заключается в простом правиле - элементарный йод легко восстанавливается до йодида. Если титровать его раствор раствором восстановителя известной концентрации до исчезновения окраски, то по использованному объему можно будет рассчитать концентрацию анализируемого вещества, т.е. содержание йода. Если, с другой стороны, у нас есть раствор вещества, реагирующего с йодом неизвестной концентрации, мы можем добавить к нему известное количество йода, чтобы сделать его избытком, и оттитровать оставшийся йод. зная, сколько было потеряно из первоначального количества добавленного йода, мы можем вычислить, сколько должно было быть в растворе реагирующего вещества.
Противоположный случай, когда у нас есть неопределенный раствор вещества, способного окислять йодид до свободного йода - тогда мы добавляем известное количество йодидов и титруем образовавшийся в реакции йод.
В качестве восстановителя обычно используется тиосульфат натрия, который быстро реагирует по реакции:
I 3 - + 2 S 2 O 3 2- → S 4 O 6 2- + 3 I -918 2- + 3 I -4918 2- + 3 I -4918 2- + 3 I -4 2- + 3 I -8 2- + 3 I - Что вы можете иметь в виду? Непосредственно сульфиты, сульфиды мышьяка III, глюкозы и аскорбиновой кислоты, косвенно свободные хлораты, хлораты, нитриты, соли меди II и железа III. Вот и все.
Так уж получилось, что из видео титрования, которые я сделал, больше всего йодометрического титрования, и я недавно выпустил одно из них. Я сделал это во время стажировки в Седльце LOŚP, и анализируемый раствор был сульфитным эталоном:
На самом деле это самая важная минута титрования. Количество йода уменьшается, а вместе с ним и оттенок раствора. Когда раствор станет соломенного цвета, добавляю крахмальную суспензию - так мне будет легче уловить конечную точку, когда исчезнут последние тона цвета.Смотрите также















