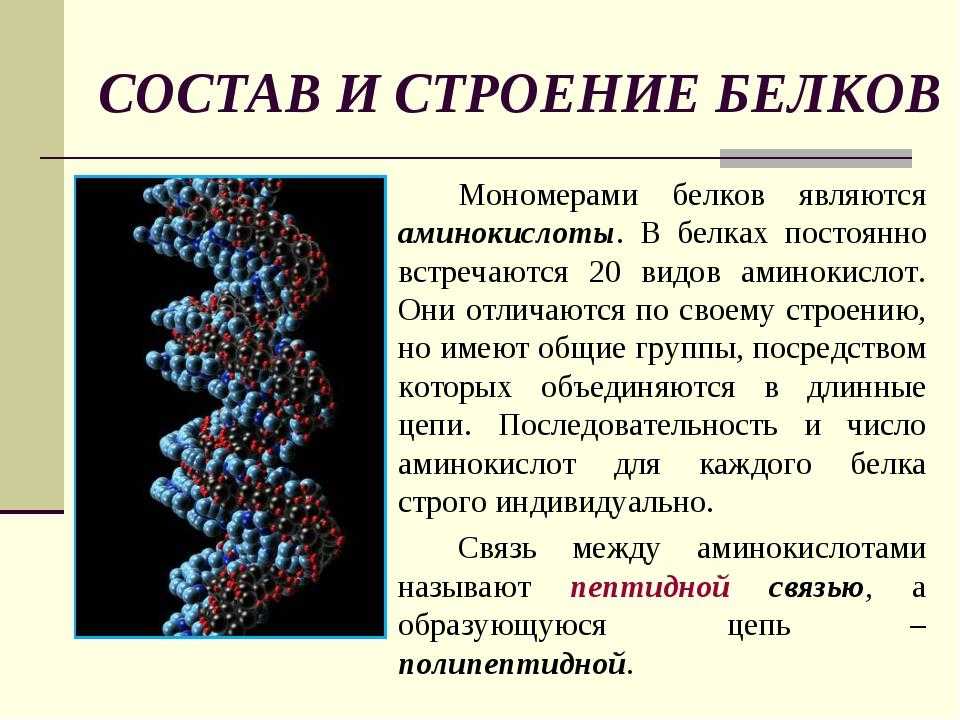
Описание яичного белка альбумина состоит из аминокислот
ХиМиК.ru - АЛЬБУМИНЫ - Химическая энциклопедия
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
АЛЬБУМИНЫ (от лат. albumen, род. падеж albuminis- белок), водорастворимые глобулярные белки, входящие в состав сыворотки крови, цитоплазмыклеток животных и растений, молока. наиб. известны сывороточный и яичный альбумин, а также лактальбумин (гл. компоненты соотв. сыворотки крови, яичного белка и молока).
Сывороточный альбумин составляет 50% от массы всех содержащихся в сыворотке
крови белков. Состоит из одной по-липептидной цепи (мол. м. 66,5 тыс.),
включающей 585 аминокислотных остатков и образующей 9 петель, фиксированных
17 дисульфидными связями. Предполагается, что цепь уложена в три более
или менее независимых кооперативных домена.
В молекуле имеется одна своб.
меркапто-группа, к-рая может участвовать в образовании дисульфидов, что
лежит в основе пускового механизма денатурации этого белка.
Полипептидная цепь синтезируется в гепатоцитах печени в виде предшественника - проальбумина, из к-рого альбумин образуется путем отщепления N-концевого пептида. Сильно подвержен пост-трансляционной модификации, в результате к-рой возникает множество фракций, различающихся изо-электрич. точкой.
Сывороточный альбумин обеспечивает ок. 80% осмотич. давления крови, создаваемого высокомол. компонентами. Предполагается, что его осн. ф-ция - транспорт в организме низкомол. в-в, напр. жирных к-т, липидов, билирубина, ионов нек-рых металлов, аминокислот. Он связывает также почти все лек. ср-ва и т. обр. пролонгирует их действие.
Получают альбумины осаждением из плазмы крови или др. биол. объектов разведенным
водным р-ром этанола на холоду. Сывороточный альбумин человека широко используется
как кровезаменитель и компонент питательных сред, альбумин из яичного белка и
молока - в кондитерской пром-сти.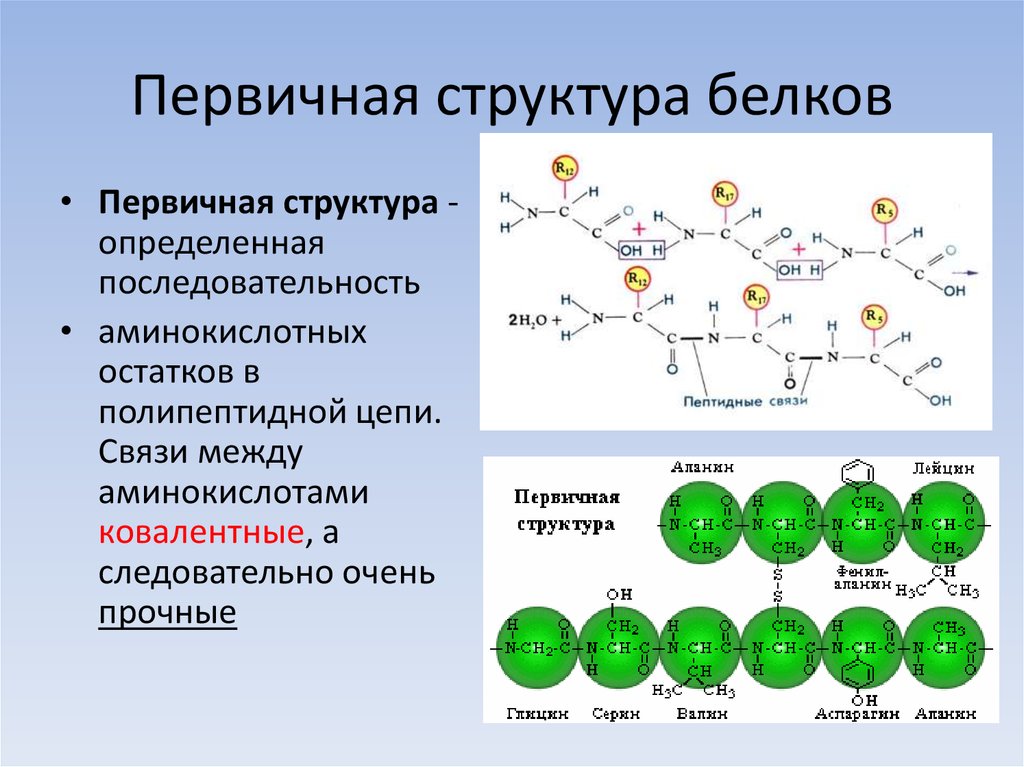
===
Исп. литература для статьи «АЛЬБУМИНЫ»: Луйк А.И., Лукьянчук В. Д., Сывороточный альбумин и биотранспорт
ядов, М., 1984; Albumin. Structure, biosynthesis, function, ed. by T. Peters,
I. Sjoholm, Oxf., 1978. Г. Ю. Амсицкий.
Страница «АЛЬБУМИНЫ» подготовлена по материалам химической энциклопедии.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Еще по теме:
- Альбумин - биохимический справочник
- Альбумин - лекарственные препараты
Белки — химический состав, структура, общая формула
Поможем понять и полюбить химию
Начать учиться
Белки — основной строительный материал клеток, они составляют 15–20% общей массы человека. Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Что такое белок. Химический состав и образование белков
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой.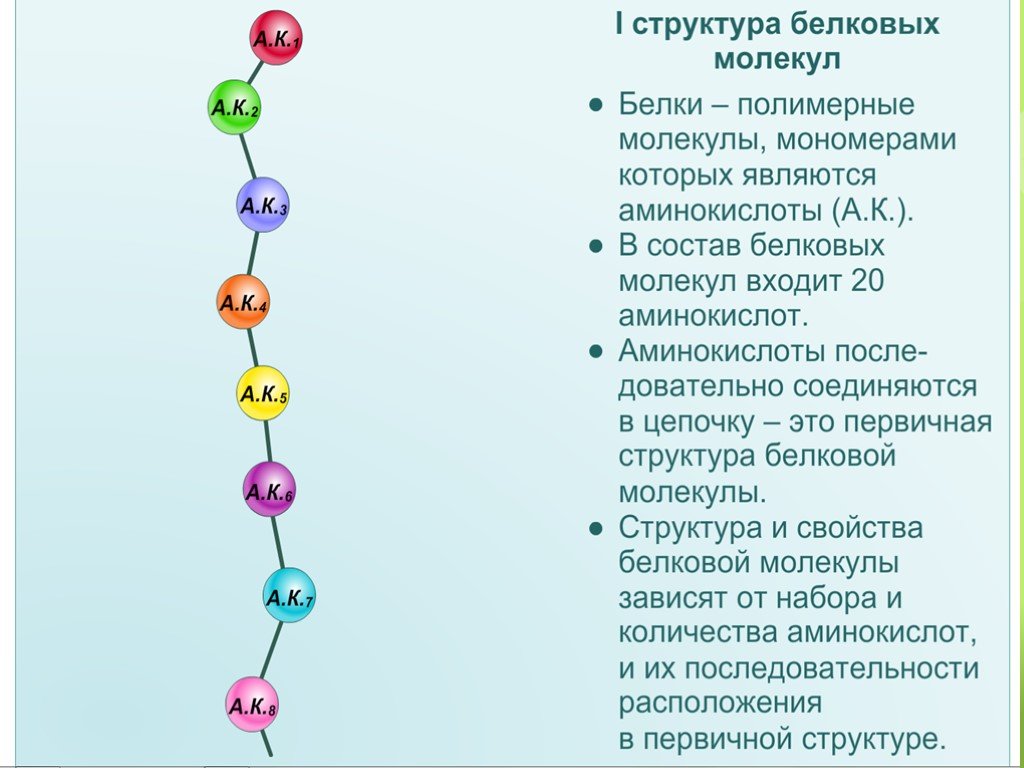 Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.
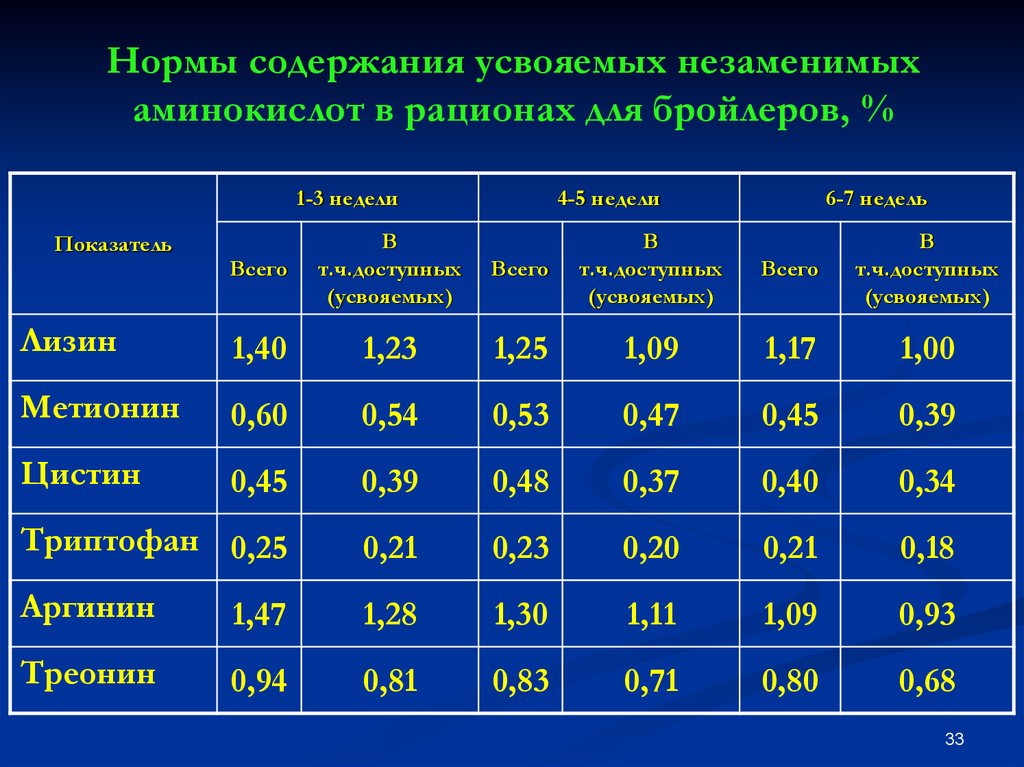
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты — это те, которые организм может синтезировать самостоятельно или получить с продуктами питания.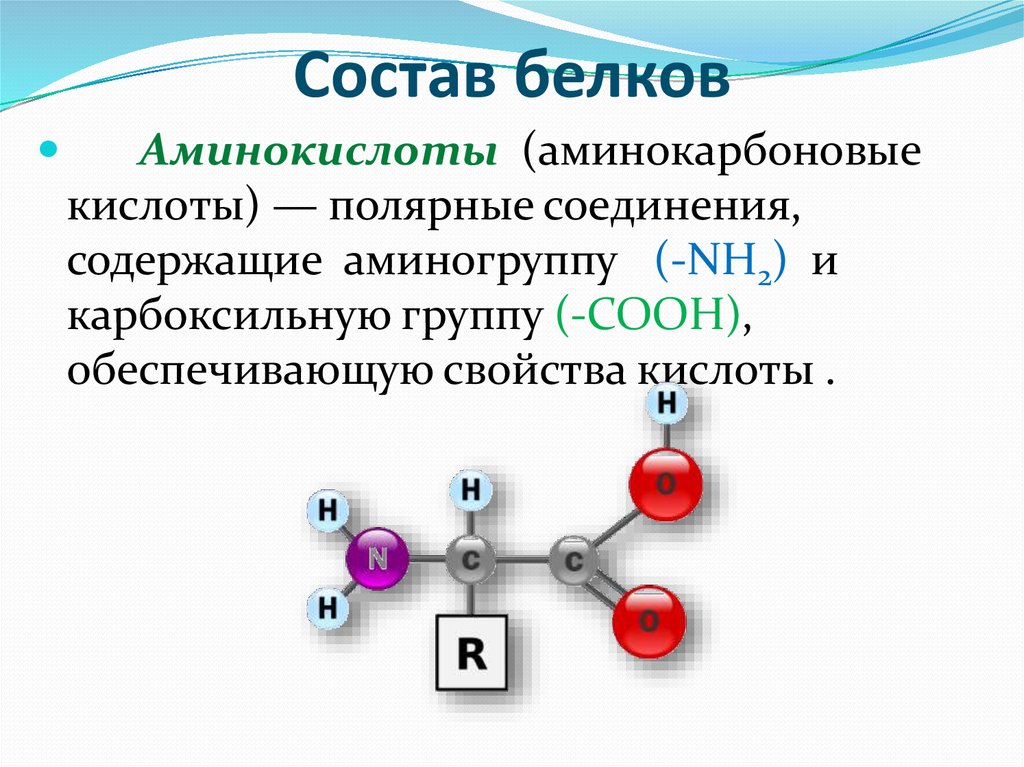 К ним относятся:
К ним относятся:
| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
аспартат используется для процессов регенерации;
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях.
 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина; тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
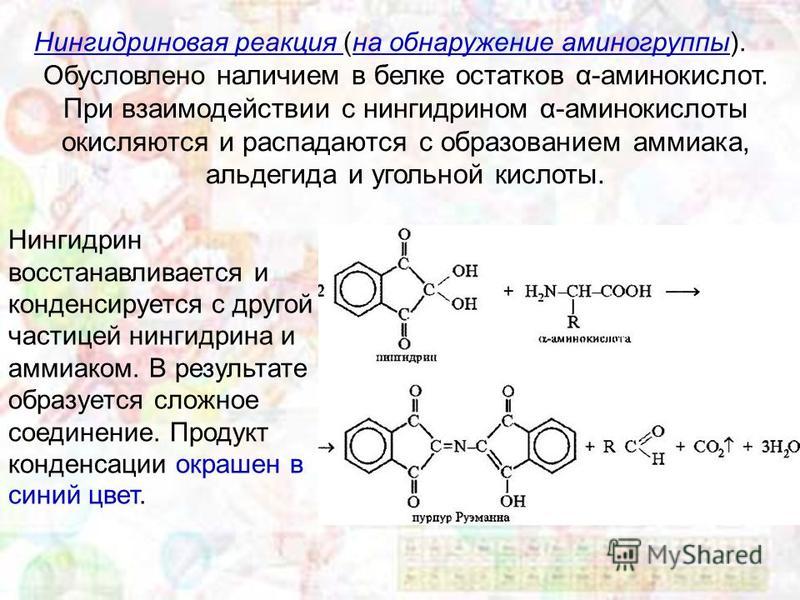
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
Основные различия — это структура и размер.
 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
форма молекулы глобулярных белков — глобула (сфера или эллипс).
 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде; форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.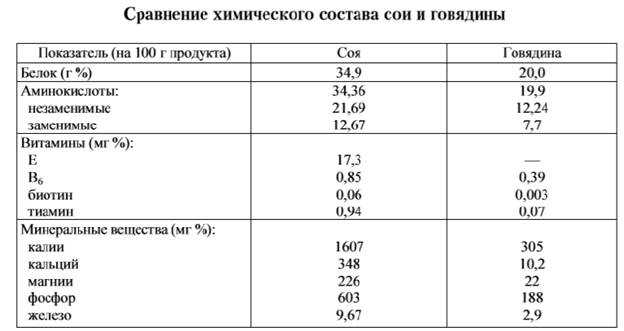
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок.
 Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи.
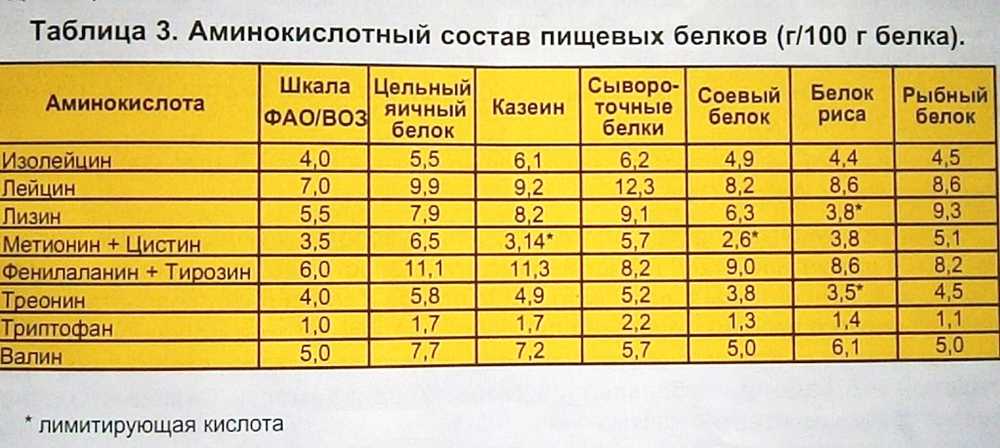 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы. Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Ксения Боброва
К предыдущей статье
Тепловой эффект
К следующей статье
Моносахариды
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Яичный альбумин Белок – водорастворимые белки
Не путать с альбумином (яичный белок). Альбумины представляют собой класс водорастворимых белков, содержащихся в яичном белке, а также в молоке и сыворотке крови. Все вещества, содержащие альбумины, известны как альбуминоиды. Хотя яичный белок состоит в основном из воды, около 10% прозрачного и вязкого вещества содержит белки, такие как альбумины, глобулины и мукопротеины. Белок яичного альбумина является ценным ингредиентом многих пищевых продуктов, включая корма и лакомства для домашних животных, благодаря своим питательным свойствам и способности термически коагулировать и связывать ингредиенты вместе.
Альбумины представляют собой класс водорастворимых белков, содержащихся в яичном белке, а также в молоке и сыворотке крови. Все вещества, содержащие альбумины, известны как альбуминоиды. Хотя яичный белок состоит в основном из воды, около 10% прозрачного и вязкого вещества содержит белки, такие как альбумины, глобулины и мукопротеины. Белок яичного альбумина является ценным ингредиентом многих пищевых продуктов, включая корма и лакомства для домашних животных, благодаря своим питательным свойствам и способности термически коагулировать и связывать ингредиенты вместе.
Яичный альбумин Белок
В отличие от желтка яичный белок содержит очень мало жира и не содержит холестерина, что делает его важным ингредиентом в пищевой промышленности. На его долю приходится более половины веса яйца, и это отличный источник белка. Простая форма белка, белок яичного альбумина, обладает несколькими уникальными характеристиками, которые делают его чрезвычайно полезным для производителей кормов для домашних животных.
Во-первых, как мы упоминали ранее, он предлагает термическую коагуляцию. После первого разбивания яйца вы можете увидеть полупрозрачный и мягкий, жидкий характер яичного белка. При приготовлении тепло вызывает денатурацию, отвердевание белка и окрашивание его в непрозрачный белый цвет. Изменения вязкости и цвета отражают денатурацию белка яичного альбумина.
Далее, альбумин водорастворим. Эта характеристика способствует включению и диспергированию белка при приготовлении кормов или лакомств для домашних животных. Когда белок обладает высокой растворимостью, спектр его потенциального применения может расшириться. Белок яичного альбумина также растворим в разбавленных солевых растворах.
Типы альбуминов в яичном белке
В семейство альбуминов входит множество различных белков. Каждый из этих функциональных белков имеет определенную цель: от помощи в процессе пищеварения и связывания клеток до укрепления иммунной системы. Они помогают разработчикам пищевых продуктов, поскольку они работают над преодолением проблем с рецептурами. В яичном белке вы найдете два преобладающих белка:
В яичном белке вы найдете два преобладающих белка:
- Овальбумин: Основной белок яичного белка, овальбумин обеспечивает питание и связывает пищеварительные ферменты. Он составляет примерно 54% белка яичного белка (источник).
- Овотрансферрин: Овотрансферрин, гликопротеин, является наиболее термолабильным белком в яичном альбумине (это означает, что это первый белок, который начинает гелеобразовать при нагревании альбумина). Ранее известный как кональбумин, он составляет примерно 12% белка яичного альбумина.
Другие белки яичного белка включают овомукоид, овомуцин, глобулин и лизоцим. В дополнение к белку яичный белок содержит питательные вещества, такие как магний, рибофлавин, калий, натрий и ниацин, а также минералы, такие как цинк, фосфор, медь и кальций.
Одним из больших преимуществ яичного альбумина является то, что, в отличие от многих других продуктов, он практически не теряет своей питательной ценности при приготовлении. Рассмотрите возможность добавления инновационных сухих яичных продуктов IsoNova, таких как OvaBind™ (патент № 8,9).16,156), Ova 70 или OvaTrition™ в корм или лакомства для домашних животных, чтобы использовать альбумины яичного белка. Чтобы узнать больше о наших яичных продуктах и о том, как их можно настроить и улучшить в соответствии с вашими конкретными потребностями, свяжитесь с IsoNova® сегодня.
Рассмотрите возможность добавления инновационных сухих яичных продуктов IsoNova, таких как OvaBind™ (патент № 8,9).16,156), Ova 70 или OvaTrition™ в корм или лакомства для домашних животных, чтобы использовать альбумины яичного белка. Чтобы узнать больше о наших яичных продуктах и о том, как их можно настроить и улучшить в соответствии с вашими конкретными потребностями, свяжитесь с IsoNova® сегодня.
Наука о яйцах: наука о яйцах
Яйцо белки меняются, когда вы их нагреваете, взбиваете или смешиваете с другие ингредиенты. Понимание этих изменений может помочь вам понять роль, которую яйца играют в кулинарии.
Белки состоят из длинных цепочек аминокислот. Белки в яичном белке являются глобулярными белками, а это означает, что длинная белковая молекула скручивается, складывается и сворачивается в более или менее сферическую форма. Разнообразие слабых химических связей удерживает белок в свернутом состоянии. плотный, когда он спокойно дрейфует в воде, которая его окружает.
Разнообразие слабых химических связей удерживает белок в свернутом состоянии. плотный, когда он спокойно дрейфует в воде, которая его окружает.
Тепловая энергия
Когда вы нагреваете, вы взбалтываете эти безмятежно дрейфующие белки яичного белка, подбрасывая их вокруг. Они врезаются в окружающие молекулы воды; они врезаются друг в друга. Вся эта болтовня ломает слабых связи, удерживающие белок свернутым. Яичные белки разворачиваются и столкнуться с другими белками, которые также развернулись. Новые химические связи образуются, но вместо того, чтобы связывать белок с самим собой, эти связи соединять один белок с другим.
После Хватит этого избиения и склеивания, одиночные яичные белки одиноких уже нет. Они сформировали сеть взаимосвязанных белки. Вода, в которой когда-то плавали белки, улавливается и удерживается в белковой сети. Если оставить яйца при высокой температуре слишком долго, образуется слишком много связей, и яичный белок становится резиновым.
Если оставить яйца при высокой температуре слишком долго, образуется слишком много связей, и яичный белок становится резиновым.
Эксперимент с подогревом яиц путем жесткой варки яиц, приготовив фаршированные яйца или сделав флан.
Бит em
Когда вы взбиваете сырые яичные белки, чтобы сделать суфле или безе, вы включаете пузырьки воздуха в водно-белковый раствор. Добавление пузырьки воздуха к яичным белкам разворачивают эти яичные белки точно так же по мере их нагрева.
Кому понять, почему введение пузырьков воздуха заставляет яичные белки разворачиваться, вам нужно знать основной факт об аминокислотах, входящих в состав белки. Некоторые аминокислоты притягиваются к воде; они гидрофильный , или водолюбивый. Другие аминокислоты отталкиваются по воде; они гидрофобны, или боятся воды.
Яичный белок белки содержат как гидрофильные, так и гидрофобные аминокислоты. Когда белок свернут, гидрофобные аминокислоты упакованы в центре от воды, а гидрофильные на снаружи ближе к воде.
Когда яичный белок противостоит воздушному пузырю, часть этого белка подвергается воздействию воздуха, а часть все еще находится в воде. Белок разворачивается чтобы его водолюбивые части можно было погружать в воду и его боящиеся воды части могут торчать в воздухе. Как только белки разворачиваясь, они соединяются друг с другом — точно так же, как при нагревании — создавая сеть, которая может удерживать пузырьки воздуха на месте.
Когда вы нагреваете эти захваченные пузырьки воздуха, они расширяются по мере того, как газ внутри их нагревает. При правильном обращении сеть, окружающая пузыри затвердевает при нагревании, и конструкция не разрушается когда пузыри лопнут.
Эксперимент с вспенивающимися яичными белками, делая Павлова.
Микс em вверх
Все знает, что, предоставленные сами себе, нефть и вода не смешивание. Но во многих рецептах вы смешиваете жидкости на масляной и водной основе — и хочу, чтобы они такими и оставались. Часто на помощь приходят яичные желтки. путем создания 9Эмульсия 0067.
Большинство пищевые эмульсии известны как масло-в-воде, что означает, что капли масла (или жира) рассредоточены по всей воде. Положите масло и воды в банке, энергично встряхните, и вы разойдетесь. масло. Однако, чтобы капли масла не сливались, требуется вещество, известное как эмульгатор . Яичный желток содержит ряд эмульгаторов, поэтому яичные желтки так важны при приготовлении таких продуктов, как голландский соус и майонез.